Solubilidade
- Home
- Solubilidade
Solubilidade de uma substância em determinado solvente é a quantidade máxima, em massa, dessa substância que se dissolve em 100g do solvente (normalmente água) a uma temperatura e pressão especificadas. A substância dissolvida é chamada de soluto.
A solubilidade de cada substância foi determinada experimentalmente em laboratórios de precisão e seu valor constitui uma das propriedades físicas das substâncias; esse valor, em geral, é apresentado na forma de tabelas.
Vamos tomar como exemplo a solubilidade do nitrato de potássio (KNO3).
Solubilidade do Nitrato de Potássio ( KNO3 )
A figura indica que em 100 g de água, a 10 °C, dissolveram-se, no máximo, 20,9 g de KNO3.
- 20,9 g de KNO3 é o Coeficiente de Solubilidade (C.S) do KNO3, a 10 °C.
Mudando a temperatura, mudamos a quantidade a ser dissolvida, observe:

Nesse caso, foram adicionados 40 g de KNO3 e 8,4 g não se dissolveram. Assim, sabemos que 31,6 g foram dissolvidos. Portanto, em 100 g de água a 20 °C dissolveram-se 31,6 de KNO3.
|
Temperatura
(oC) |
Coeficiente de solubilidade
g KNO3/100 g H2O |
|
0 |
13,3 |
|
10 |
20,9 |
|
20 |
31,6 |
|
30 |
45,8 |
|
40 |
63,9 |
|
50 |
85,5 |
|
60 |
110 |
|
70 |
138 |
|
80 |
169 |
|
90 |
202 |
|
100 |
246 |
Interpretação:
A 0 °C conseguimos dissolver, no máximo, 13,3 g de KNO3 em 100 g de água.
Se alterarmos a quantidade de água, alteramos proporcionalmente a quantidade a ser dissolvida, (soluto), ou seja: se dobrarmos a quantidade de água, dobramos a massa de sal que conseguimos dissolver.
Se multiplicarmos a massa de água por dez, fazemos o mesmo com a massa de sal, a ser dissolvida.
Com os dados da tabela, construímos um gráfico denominado curva de solubilidade.
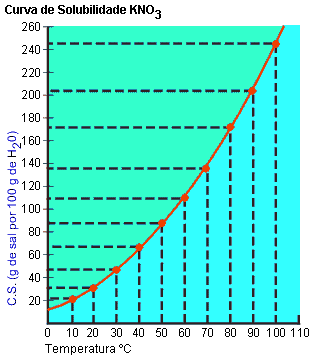 |
Temperatura
(°C) |
Coeficiente de solubilidade
g KNO3/100 g H2O |
|
0
|
13,3
|
|
|
10
|
20,9
|
|
|
20
|
31,6
|
|
|
30
|
45,8
|
|
|
40
|
63,9
|
|
|
50
|
85,5
|
|
|
60
|
110
|
|
|
70
|
138
|
|
|
80
|
169
|
|
|
90
|
202
|
|
|
100
|
246
|
O mais comum é colocar num único eixo as curvas de solubilidade de várias substâncias.
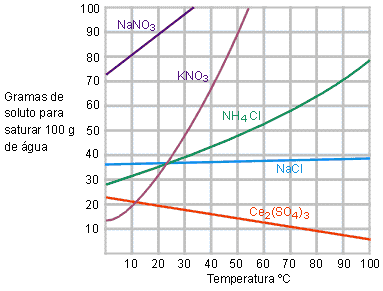 |
Nesta comparação é possível perceber que cada substância tem um comportamento diferente com relação à solubilidade e o aumento da temperatura. Por isso dizemos que se a temperatura variar, variamos a solubilidade. A solubilidade pode aumentar muito, ou pouco, ou até mesmo diminuir, isso dependerá de cada substância.
Vamos fazer agora algumas comparações em relação à solubilidade dessas substâncias.
1) Dentre as substâncias, qual é a mais solúvel a 0 °C?
Perceba que à temperatura (0 °C) a substância que conseguimos dissolver a maior quantidade, portanto a mais solúvel é o NaNO3.
2) Qual dessas substâncias é a menos solúvel a 0 °C?
Na temperatura de 0 °C, a substância que se dissolve em menor quantidade, portanto a menos solúvel é KNO3.
Tipos de Soluções
- Solução saturada: quando dissolvemos exatamente a quantidade máxima de soluto, ou seja, o que determina o coeficiente de solubilidade.
- Solução insaturada: quando dissolvemos uma quantidade inferior à quantidade máxima.
- Solução supersaturada: quando está dissolvido uma quantidade superior à quantidade máxima.
É possível dissolver uma quantidade superior à quantidade máxima de soluto, fazendo assim a solução supersaturada. Mas essa solução é muito instável.
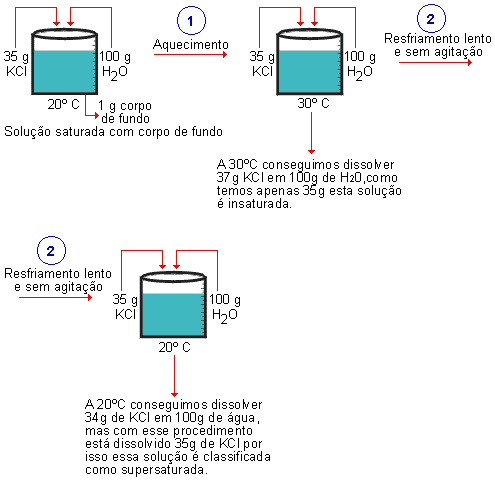
Um bom exemplo de solução supersaturada são as bebidas gaseificadas, refrigerantes, por exemplo. Neles há uma supersaturação de gás carbônico (CO2), dissolvido sob pressão superior a 1 atm. Quando abrimos a garrafa, pressão interna diminui e todo o CO2 em excesso já não se dissolve; como o gás é menos denso que a água (o solvente), ele sobe para a superfície e sai para o meio ambiente. Se você agitar o refrigerante, ou adicionar sal ou açúcar, vai fazer acelerar a saída desta quantidade excessiva de gás carbônico.
|
Solubilidade de gases em um líquido: |
Vimos que, no caso de solutos sólidos em água, a solubilidade pode aumentar ou diminuir com o aumento da temperatura. Mas, no caso da solubilidade de gases em um líquido, a solubilidade sempre aumenta com o aumento da pressão e diminuição da temperatura.
Quando abrimos a garrafa de um refrigerante, diminuímos a pressão e solubilidade do gás diminui. Logo, o excesso de gás sai para o meio ambiente. Você deve ter reparado que, se o refrigerante não está gelado, a quantidade de gás que sai é maior. Isso acontece porque em temperatura maior, a solubilidade do gás diminui, e o excesso sai da garrafa.
Poluição térmica
As usinas nucleares e algumas indústrias, são instaladas perto de rios, para utilizar a água no sistema de refrigeração de seus equipamentos. Esse processo resfria os equipamentos e aquece a água, que é devolvida ao rio. O aquecimento da água nos rios causa a morte de peixes e de muitos outros seres vivos, mesmo sendo a água não poluída por substâncias tóxicas, porque a temperatura da água aumenta e, com isso, diminui a quantidade de oxigênio dissolvido, fundamental para a sobrevivência dos peixes.
Sumário
- Solubilidade- Tipos de Soluções
- Poluição térmica
Áreas exclusivas para assinantes






