Mudanças de Estado - Diagrama de Fases
- Home
- Mudanças De Estado Diagrama De Fases
Mudanças de Estado - Diagrama de Fases
Anteriormente vimos que uma substância pura pode se apresentar em três estados de agregação (ou fases): sólido, liquido e gasoso. Na realidade existem um quarto estado denominado plasma. Porém esse é um caso especial.
Quando uma substância muda de estado, sofre uma variação de volume. Isto significa que alterações da pressão externa podem ajudar ou dificultar a mudança de estado. No capítulo anterior nos limitamos a mudanças que acorrem com pressão externa fixa de 1 atmosfera. Sob essa pressão vimos, por exemplo, que a água entra em ebulição a 100ºC. No entanto se, por exemplo, diminuirmos a pressão externa, a água entrará em ebulição em temperaturas menores. Na cidade de São Paulo, que está a 700 metros acima do nível do mar, a água entra em ebulição a 98ºC. Isto acorre porque nessa altitude a pressão atmosférica é menor do que 1 atmosfera.
Nesta aula analisaremos as influências conjuntas da pressão e da temperatura no estado de agregação.
DIAGRAMAS DE ESTADO
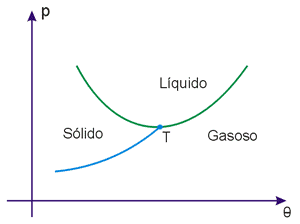
A Fig.1 apresenta um diagrama de estado típico da maioria das substâncias.
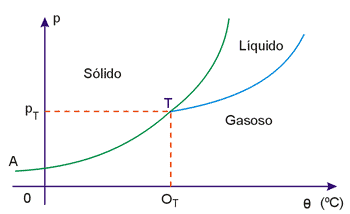
Fig. 1
Esse diagrama nos mostra os valores de pressão e temperatura para os quais a substância se encontra em cada estado de agregação.
A curva TB é chamada curva de fusão. Para os valores de pressão e temperatura que correspondem aos pontos dessa curva, a substância pode apresentar em equilíbrio as fases sólida e líquida.
A curva TC é a curva de vaporização. Seus pontos correspondem a valores de temperatura e pressão em que as fases líquida e gasosa podem ficar em equilíbrio.
A curva AT é a curva de sublimação. Seus pontos correspondem a valores de pressão e temperatura em que as fases sólida e gasosa podem ficar em equilíbrio.
O ponto T é chama de ponto triplo (ou tríplice), sob pressão p T e à temperatura θ T, a substância pode apresentar em equilíbrio as três fases: sólida, líquida e gasosa.
Exemplo 1
A figura a seguir nos mostra o diagrama de estado para o dióxido de carbono (CO2).
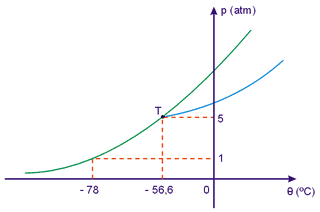
Por esse diagrama vemos que, à temperatura de - 56,6ºC e sob pressão de 5 atmosferas, o CO2 pode apresentar em equilíbrio as três fases. Sob pressão de 1 atmosfera não encontramos o CO2 no estado líquido: ou ele está no estado sólido ou gasoso.
Vamos analisar agora, separadamente, as três curvas.
CURVA DE FUSÃO
Durante a fusão a maioria das substâncias se expandem. Portanto, para essas substâncias, um aumento de pressão dificulta a fusão e assim o aumento da pressão acarreta um aumento da temperatura de fusão. Assim, para essas substâncias, a curva de fusão tem aspecto da Fig. 2.

Fig. 2 - Curva de fusão de uma sustância que se expande na fusão:
![]()
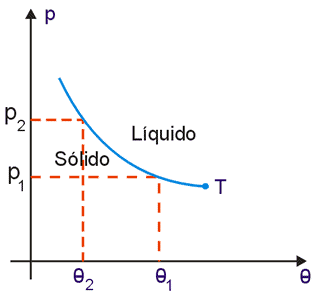
Há porém algumas substância que se contraem durante a fusão. É o caso, por exemplo, da água, do ferro e do bismuto. Para essas substâncias um aumento de pressão facilita a fusão. Desse modo, o aumento de pressão acarreta uma diminuição na temperatura de fusão. Para essas substâncias a curva de fusão tem o aspecto da Fig. 3 e o diagrama completo tem aspecto de Fig. 4.
|
|
|
|
Fig. 3 - Curva de fusão para uma substância que se contrai na fusão:
|
Fig. 4 - Diagrama de estado para uma substância que se contrai na fusão.
|
Exemplo 2
Sob pressão normal (1 atmosfera) o gelo se funde a 0ºC. Numa pista de gelo destinada à patinação, o gelo encontra-se a uma temperatura um pouco inferior a 0ºC. Quando a lâmina do patim comprime o gelo, este fica submetido a uma pressão superior a 1 atmosfera e, assim, se funde a uma temperatura inferior a 0ºC, formando-se sob a lâmina uma pequena camada de água líquida que é o que facilita o deslizamento do patim. Após a passagem do patim, a pressão sobre a pista volta a ser 1 atmosfera e a água solidifica-se.
CURVA DE VAPORIZAÇÃO
Os pontos da curva de vaporização correspondem aos valores de pressão e temperatura em que a substância entra em ebulição.
Todas as substâncias se expandem ao entrarem em ebulição e assim, um aumento de pressão dificulta a ebulição. Portanto um aumento de pressão provoca um aumento da temperatura de ebulição. Desse modo as curvas de vaporização têm o aspecto da Fig. 5.
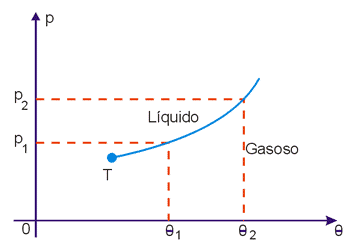
Fig. 5 - Curva de vaporização
Temperatura Crítica
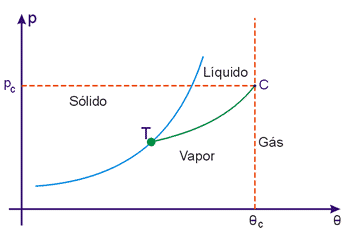
Existe uma temperatura, denominada temperatura crítica (θ2) acima da qual, por maior que seja a pressão, a substância encontra-se no estado gasoso. Por isso é costume fazer uma distinção entre gás e gás e vapor:
- gás é uma substância no estado gasoso, acima da temperatura crítica.
- vapor é uma substância no estado gasoso abaixo da temperatura crítica.
Desse modo, os diagramas de estado ficam com os aspectos da Fig. 6 (substâncias que se expandem na fusão) e da Fig. 7 (substâncias que se contraem na fusão). Nessas figuras, C é o ponto crítico, definido pela temperatura crítica θc e pela pressão crítica pc.
|
|
|
|
Fig. 6
|
Fig. 7
|
EVAPORAÇÃO E EBULIÇÃO
A passagem do estado líquido para o gasoso pode ser feita por dois processos: evaporação e ebulição.
A evaporação é uma vaporização que pode ocorrer em qualquer temperatura, pela superfície do líquido em contado com o ambiente. Esse processo ocorre pela fuga das moléculas mais energéticas do líquido e por isso acarreta um esfriamento do líquido. Quando uma pessoa sai molhada de um banho ou de uma piscina, "sente frio": a evaporação da água retira calor do corpo da pessoa.
A ebulição é uma vaporização que envolve todo o líquido e acontece a uma temperatura determinada (para cada valor de pressão).
CURVAS DE SUBLIMAÇÃO
Os pontos da curva de sublimação correspondem aos valores de pressão e temperatura em que podem ficar em equilíbrio os estados sólido e gasoso.
Quando uma substância passa do estado sólido para o gasoso, aumenta de volume e, assim, um aumento de pressão dificulta a transformação. Portanto o aumento de pressão acarreta um aumento da temperatura em que ocorre a sublimação e assim, as curvas têm o aspecto da Fig. 8.
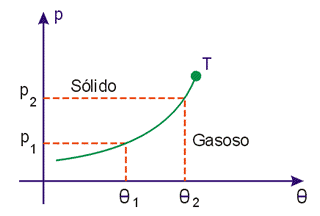
![]()
Fig. 8
Sumário
- Diagramas de estado
- Curva de Fusão
- Curva de vaporização
i. Temperatura Crítica
- Evaporação e Ebulição
- Curva de sublimação
Áreas exclusivas para assinantes