Termoquímica
- Home
- Termoquímica
Termoquímica que é o ramo da Físico-Química que estuda a energia na forma calor envolvido nas reações.
A termoquímica se preocupa com o saldo energético das reações químicas.
Analisamos a energia (calor) inicial e a energia (calor) final. A diferença entre os estados final e inicial nos dá este saldo
Entalpia (H) → vamos chamar de entalpia a energia na forma de calor de cada substância.
| Variação de Entalpia (ΔH) → saldo energético → | ΔH = Hfinal - Hinicial |
Como o final da reação são os produtos e o início os reagentes temos:
| ΔH = Hprodutos - Hreagentes |
Temos dois tipos de reações termoquímicas, são elas:
Reações exotérmicas
Representa uma perda de energia pelo sistema: ΔH < 0.
São reações que liberam calor, ou seja, as substâncias produzidas apresentam menos energia do que as substâncias que reagiram, (Hreag. > Hprod.) fazendo assim uma variação de entalpia negativa.
Graficamente:
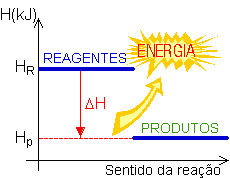
Representando um exemplo através da equação:
C + O2(g) → CO2(g) ΔH = -94kcal
Reações endotérmicas
Representa um ganho de energia pelo sistema: ΔH > 0.
São reações que absorvem calor do meio produzindo substâncias mais energéticas.
Nas reações endotérmicas os produtos apresentam maior entalpia que os reagentes: (Hp > Hr) portanto o saldo energético é positivo (ΔH > O).
Graficamente:
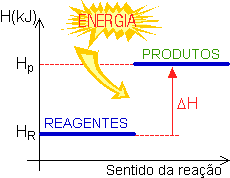
Podemos representar a variação da entalpia (ΔH) de uma reação endotérmica através da equação da reação.
Por exemplo
2NH3(g) → N2(g) + 3H2(g) ΔH = +22kcal
Resumindo
|
Reações Termoquímicas: Exotérmicas - liberam calor - ΔH < O Endotérmicas - absorvem calor - ΔH > O |
Exemplo
Quando você acende uma das bocas do fogão percebe facilmente todo calor liberado (processo exotérmico) ao colocar uma panela com água, esta absorve o calor que está sendo liberado pela chama e alcança a ebulição (ferve).
Como a água absorve calor para ferver, temos um processo endotérmico.
FATORES QUE INFLUEM NA VARIAÇÃO DA ENTALPIA
Estado Físico
Para uma mesma substância:
H(g) > H(l) > H(s)
O simples fato de uma substância se apresentar nos estados gasoso, líquido e sólido altera a entalpia da reação. Desta maneira, por exemplo, para fundir ou vaporizar uma substância é necessário fornecer energia.
Exemplos
|
SUBSTÂNCIAS |
ENTALPIA (H) |
|
H2O(L) |
- 68 kcal / mol |
|
H2O(g) |
- 58 kcal / mol |
|
H2O(s) |
- 70 kcal / mol |
Forma Alotrópica
A forma alotrópica mais estável possui menor nível de energia. É preciso fornecer energia para transformar a forma alotrópica mais estável na menos estável.
Exemplo
C(grafite) + O2 (g) → CO2 (g) ΔH = - 393,1 kJ/mol
C(diamante) + O2 (g) → CO2 (g) ΔH= - 395,0 kJ/mol
C(grafite) - mais estável
C(diamante)- menos estável
Associação ou dissociação de átomos
Para romper ligações entre os átomos é necessário fornecer energia.
Quantidade de reagentes e de produtos
A quantidade de calor é diretamente proporcional à quantidade de substância. Isto significa:
|
A operação (multiplicação ou divisão) feita na quantidade de substância é a mesma que devemos fazer com a quantidade de calor. |
Exemplos
Se pegarmos a metade da quantidade de substância, dividimos por dois a quantidade de calor.
Se multiplicarmos por dez a quantidade de substância, multiplicamos por dez a quantidade de calor.
Exercícios resolvidos.
Algumas entalpias de formação (substância).
|
SUBSTÂNCIAS
|
ENTALPIA (H)
|
||
|
H2O(L)
|
- 68 kcal / mol
|
||
|
H2O(g)
|
- 58 kcal / mol
|
||
|
H2O(s)
|
- 70 kcal / mol
|
||
|
CO2(g)
|
- 94 kcal / mol
|
||
|
CH4(g)
|
- 18 kcal / mol
|
CH4 = gás metano (principal constituinte do gás natural) |
|
|
C2H6O(L)
|
- 66 kcal / mol
|
C2H6O = álcool etílico (etanol) |
Exercício 1
Calcule o ΔH de combustão do etanol.
Resolução
| C2H6O(l) + 3O2(g) | → | 2CO2(g) + 3H2O(l) | Da tabela temos: C2H6O(l) = - 66 kcal / mol CO2(g) = -94 kcal / mol H2O(l) = - 68 kcal / mol |
|
|
↓
|
↓
|
|||
|
Reagentes
|
Produtos
|
|||
| O2(g) → | não aparece na tabela porque é substância simples portanto H = O | |||
| ΔH = Hp - Hr | ||||
| ΔH = (2CO2(g) + 3H2O(l)) - (C2H6O(l) + 3O2(g)) | ||||
| ΔH = (2(-94) + 3(- 68)) - (- 66 + 3.(0)) |
| ΔH = (-188 - 204) - (- 66 + 0) |
| ΔH = - 392 + 66 |
| ΔH = - 326 kcal |
| 1C2H6O(l) + 302(g) → 2 CO2(g) + 3H2O(l) |
ΔH=
|
-326 kcal |
|
↓ |
||
| exotérmico ΔH < O → liberação de calor |
||
1 mol de C2H6O = 46 g
A combustão de
1 mol de C2H6O (46g) libera 326 kcal
Exercício 2
Poder calorífico é a quantidade de calor liberada na queima de 1,0 kg do combustível.
Vamos calcular o poder calorífico do etanol (C2H6O), do gás metano (CH4) e da Gasolina 
Resolução
Dados:
ΔH de combustão:
Etanol = -326 kcal / mol
Gasolina (C8H18) = -1300 kcal / mol
Gás natural = - 213 kcal/mol
(CH4) principal constituinte
Calcule o poder calorífico de cada combustível.
Dado as massas molares:
C2H6O = 46 g / mol
C8 H18 = 114 g/mol
CH4 = 16 g/mol
C2H6O →ΔH = - 326 kcal / mol (Na combustão de 1 mol (46 g) de C2H6O são liberados 326 kcal)
C2H6O →1 mol = 46 g
46g → 326 kcal
1000 g → x
x = (326 . 1000)/46 = 7087 kcal
C8H18 → ΔH = - 1300 kcal / mol (Na combustão de 1 mol (114g) de C8H18 são liberados 1300 kcal)
114 g → 1300 kcal
1000 → y
y = (1300 . 1000)/114 = 11403 kcal
CH4 → ΔH = - 213 kcal / mol (Na combustão de 1 mol (16g) de CH4 são liberados 213 kcal)
16 g → 213 kcal
1000 g → z
z = (213 . 1000)/16 = 13312 kcal
Sumário
- Reações exotérmicas- Reações endotérmicas
- Fatores que influem na variação da entalpia
i. Estado Físico
ii. Forma Alotrópica
iii. Associação ou dissociação de átomos
iv. Quantidade de reagentes e de produtos
Áreas exclusivas para assinantes





