Ligação Metálica
- Home
- Ligação Metálica
Como o próprio nome indica, é a ligação química entre os átomos de metais. Qualquer porção de metal é formada por um número enorme de átomos dispostos de maneira organizada.
Os metais apresentam baixa energia de ionização e alta eletropositividade, ou seja, grande facilidade em perder elétrons da camada de valência. Assim, na ligação metálica, os átomos perdem elétrons dessa, formando cátions.
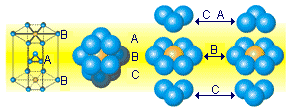
Forma-se uma quantidade muito grande de cátions envolvidos por uma quantidade enorme de elétrons livres. Dizemos que os cátions estão envolvidos por um "mar de elétrons".

A ligação metálica ocorre pela atração elétrica entre os cátions (íons positivos) e os elétrons livres. Esta atração é muito intensa, o que garante o estado sólido dos metais nas condições ambiente, exceto no caso do mercúrio, o único metal líquido.
O aglomerado organizado de cátions que se forma na ligação metálica é chamado de retículo cristalino metálico.
Em qualquer porção de metal, a quantidade de átomos do metal envolvido é muito grande e indeterminada.
Representação:
num pedaço de ferro, por exemplo, teríamos Fen; num pedaço de ouro, Aun, mas por uma questão de simplificação, utiliza-se apenas o símbolo do metal: Fe, Au, etc.
|
A ligação metálica não é explicada pela teoria do octeto. |
PROPRIEDADES DOS METAIS
-
São sólidos nas condições ambiente devido à grande força de atração elétrica entre cátions e elétrons.
-
São bons condutores de corrente elétrica. O "mar de elétrons" livres é o que garante a condutividade elétrica.
-
São bons condutores de calor.
-
São maleáveis.
-
São dúcteis, isto é, com eles pode-se produzir fios.
-
Apresentam brilho metálico característico.
Conhecer as propriedades características de um material permite identificá-lo e distingui-lo de outros que possam ser semelhantes a ele.
Por exemplo:
há um minério de ferro chamado pirita (FeS2) de cor amarela com brilho que pode ser confundido com o do ouro (a pirita é chamada de ouro dos tolos). Mas, quem conhece as propriedades do ouro não se engana pois um pedaço de ouro é muito mais pesado que um pedaço de pirita do mesmo tamanho, ou seja, o ouro é mais denso.
Consultando uma tabela de densidade:
|
douro = 19,3g/cm3 ou seja 1 cm3 de ouro pesa 19,3g |
|
|
dpirita = 5,2g/cm3 ou seja 1cm3 de pirita pesa 5,2g |
|
O ouro é a aproximadamente 4 vezes mais denso que a pirita. |
E se não soubéssemos os valores da densidade, como poderíamos fazer a diferenciação entre ouro e pirita? A identificação pode ser feita utilizando vários testes, desde que se conheçam algumas propriedades dos materiais. No caso do ouro (Au) e da pirita (FeS2) é bastante simples.
O ouro, por ser metal, conduz muito bem a corrente elétrica, o que não acontece com a pirita, que é um sal: sulfeto de ferro, isto é, um composto iônico.
O ouro, como todos os metais, é maleável, o que não acontece com a pirita. Um dos testes é riscar o material, por exemplo, com um prego: o ouro, por ser maleável, fica marcado enquanto que a pirita, por ser cristal iônico, pode quebrar-se.
Alguns metais são utilizados praticamente puros, como o cobre e o alumínio. Mas a maioria deles são empregados na produção de ligas metálicas, como aço, latão, bronze, aos inoxidáveis com diferentes características de densidade e resistência à corrosão, tração e temperatura, como as ligas metálicas utilizadas pela NASA na construção de foguetes, naves espaciais, sondas espaciais, etc.
 O cobre é utilizado como condutor elétrico. |
 O alumínio é muito utilizado em embalagens. |
Ligas Metálicas
São misturas de elementos onde pelo menos um deles é metal.
|
Metálica |
Constituição |
Utilização |
|
Aço |
Fe + C |
Estruturas metálicas. |
|
Aço inox |
Fe + C + Cr + Ni |
Utensílios domésticos. |
|
Lata |
Fe + Sn |
Acondicionamento de alimentos, tintas etc. |
|
Latão |
Cu + Zn |
Instrumentos musicais bijuterias, torneiras etc. |
|
Bronze |
Cu + Sn |
Estátuas, sinos etc. |
|
Solda |
Pb + Sn |
Solda usada pelos funileiros. |
|
Ouro - 18 |
Au + Ag + Cu |
Anéis, correntes etc. |
|
Amálgama dentário |
Hg + Ag + Sn |
Obturações |
Utilização de ligas
Lata
O comércio de bebidas como cervejas e refrigerantes sempre foi feito em recipientes de metal.
Antigamente, estes recipientes eram de lata, nome que se dava a uma liga metálica constituída de ferro e estanho (Fe + Sn). No entanto, esses recipientes, atualmente, são de alumínio puro, e continuamos chamando-os de lata.
Aço inoxidável - ( Fe + C + Cu + Ni)

Ouro - 18 (Au + Cu + Ag)

Ouro 24 (ou ouro 24 quilates) - É o ouro 100% puro. Todas as outras graduações do ouro são ligas metálicas, normalmente com prata e cobre.
Exemplos:
Ouro 12 – Apresenta metade da graduação 24, portanto é uma liga que apresenta 50% de ouro.
Ouro 18 - É uma liga metálica que apresenta 75% de ouro.
|
Ouro - 18 24 quilates - 100% 18 quilates - x x = 75% |
Sumário
- Propriedades dos Metais- Ligas Metálicas
i. Utilização de ligas
Áreas exclusivas para assinantes