Cinética Química
- Home
- Cinética Química
Cinética Química - Velocidade das Reações Químicas
Cinética Química estuda a velocidade das reações químicas. Para se estudar a Cinética Química, é antes necessário que se entenda como ocorre uma reação química.
Uma reação química ocorre através das colisões entre as substâncias reagentes. Mas essa colisão não pode ser um simples resvalo entre as moléculas: é necessário que ocorra num ângulo perfeito (de forma geometricamente favorável), para garantir a ocorrência da reação.
Na Cinética Química, é estudada a reação desde o seu início. O instante inicial (tempo = 0) é o momento em que são misturados os reagentes para que a reação ocorra.
Em qualquer reação química, no início há apenas os reagentes. Com o passar do tempo, as colisões ocorrem e os reagentes são consumidos (quantidade diminui) enquanto os produtos são formados.
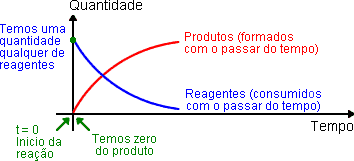
Todo gráfico que representa as quantidades de substâncias numa reação química, inclui uma curva descendente dos regentes (estes vão desaparecendo – são consumidos) e uma curva ascendente dos produtos (vão sendo formados).
Fatores que alteram a velocidade das reações
1 – TEMPERATURA
H2 + I2 ΔH 2HI

Ao aumentar a temperatura, o estado de agitação das moléculas é aumentado, o que aumenta o número de choques (colisões) efetivos. Mais substâncias reagem e, portanto, mais substâncias são produzidas, o que resulta numa maior velocidade de reações químicas.
O aumento da temperatura aumenta a velocidade de qualquer reação.
|
O aumento da temperatura aumenta a velocidade de qualquer reação. |
|
↑ Temperatura → ↑ número de colisões efetivas → ↑ velocidade da reação |
2 – CONCENTRAÇÃO DOS REAGENTES
Uma maior concentração de reagentes significa uma quantidade maior de reagentes por unidade de volume.
Em um sistema de maior concentração, há mais moléculas, o que implica num maior número de colisões. Quanto maior for o número de choques, maior será a velocidade da reação.
3 – SUPERFÍCIE DE CONTATO DOS REAGENTES
Ao aumentar a superfície de contato, aumenta-se o número de colisões; portanto, aumenta-se a velocidade das reações.
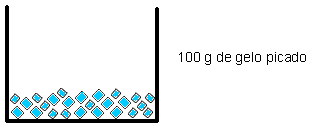
Imaginemos dois recipientes, A e B, cada um contendo 100g de gelo. No recipiente A, há um cubo de gelo cuja massa é 100g. No recipiente B, há 100g de gelo picado. Qual dos dois derreterá mais rapidamente? O gelo picado (no recipiente B), pois apresenta maior superfície de contato.
4 – CATALISADOR
Para entender o funcionamento do catalisador numa reação, é necessário saber primeiro o caminho energético de uma reação.
Para que uma reação ocorra, é necessário fornecer energia ao sistema, a fim de quebrar as ligações dos reagentes. Os reagentes absorvem o calor fornecido até alcançarem o estado intermediário entre os reagentes e produtos (complexo ativado). Neste ponto se quebram definitivamente as ligações dos reagentes e se formam as ligações do produto. Ao formar ligações, o sistema libera calor para o meio.
Essa energia que o sistema absorve para alcançar o complexo ativado é chamada de energia de ativação.
H2 + I2 → 2HI
O caminho energético da reação pode ser representado graficamente.
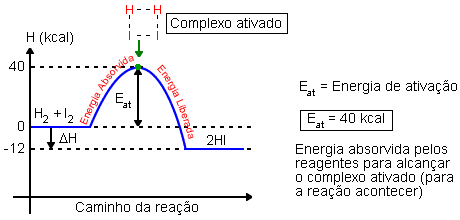
Tendo o caminho energético da reação representado graficamente, podemos calcular o saldo energético (ΔH).
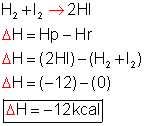
Lembre-se: como o ΔH é negativo (ΔH < 0), a reação é exotérmica.
Qual a influência exercida pela energia de ativação na velocidade de uma reação química?
Energia de ativação (Eat) é a energia necessária para que seja alcançado o complexo ativado, isto é, para que a reação aconteça.
Quanto maior for a energia de ativação, mais demorado será o processo para que se alcance o complexo ativado; portanto, menor é a velocidade da reação. Por outro lado, quanto menor for a energia de ativação, mais rapidamente será alcançado o complexo ativado; portanto, maior é a velocidade da reação.
|
Conclusão importante: |
QUANTO MENOR A Eat, MAIOR A VELOCIDADE DA REAÇÃO. |
Exemplos
Na combustão (queima), a energia de ativação é a faísca. Há uma energia de ativação pequena; portanto, a reação é muito rápida.
Catalisador
Agora que aprendemos sobre o caminho energético da reação, podemos estudar o catalisador.
O catalisador é uma substância que participa da reação, mas não participa da formação dos produtos, sendo completamente regenerado no final. O catalisador sempre aumenta a velocidade da reação, pois diminui a energia de ativação.
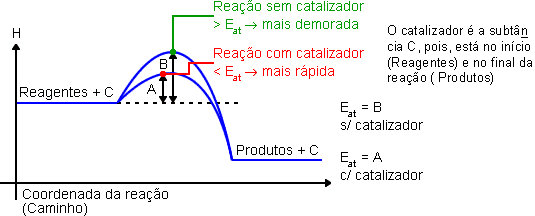
O catalisador (C) faz a reação percorrer um caminho energético mais curto, o que resulta numa reação com maior velocidade. Observe que o catalisador está no reagente e no produto, ou seja, ele participa da reação, mas não é consumido. Para não ter que escrever o catalisador nos reagentes e novamente no produto, ele é representado em cima da seta.
Observe:
![]()
Como funciona o catalisador dos carros?
Este aparelho é chamado de conversor catalítico. Dentro dele ocorrem reações (conversor) na presença de catalisador (catalítico), resultando, portanto, em reações mais rápidas.
Dentro do motor, onde ocorre a explosão (combustão), há produção de várias substâncias, como: CO2, H2O, C, CO, NO e ainda o SO2 e SO3. Quando o combustível é derivado de petróleo, num carro que não tem conversor catalítico, todas essas substâncias são lançadas no ar.
Sumário
- Cinética Química
- Fatores que alteram a velocidade das reações
i. Temperatura
ii. Concentração de reagentes
iii. Superfície de contato
iv. Catalisador
- Catalisador
Áreas exclusivas para assinantes





