Tipos de Ligações Químicas
- Home
- Tipos De Ligações Químicas
A ideia de ligação entre os átomos é tão antiga como a própria ideia de átomo. O filósofo da antiga Grécia, Epicuro, já imaginava os átomos ligando-se através de ganchos e outros artifícios mecânicos. Só no século passado é que a ideia de ligação química foi associada à capacidade de ligação de um átomo, principalmente por Couper (1864) e Kekulé (1865). Mas afinal, por que os átomos se ligam?
A primeira explicação para isso foi formulada, independentemente, por Lewis e Kössel. Em suma propunham a Teoria do Octeto. Basearam-se nas configurações eletrônicas dos gases nobres. Os gases nobres são muito pouco reativos, pois se encontram naturalmente estáveis. Isto porque os gases nobres apresentam:
- Alta energia de ionização
- Baixa eletropositividade
O que lhes confere baixa tendência de perder elétrons.
- Nenhuma eletronegatividade
- Nenhuma afinidade eletrônica
O que garante ser nula a “vontade” de ganhar elétrons.
Teoria do Octeto
Um átomo, para alcançar a estabilidade, adquire a configuração eletrônica igual à de um gás nobre, ou seja, com 8 elétrons na camada de valência, ou igual à do He, com distribuição igual a 1s2 (2 elétrons na camada K).
Os átomos ligam-se para obterem 8 elétrons na camada de valência (ou completarem a última camada).
|
Valência - é o número de ligações químicas feitas para alcançar a estabilidade. |
Portanto, um átomo para ficar estável (alcançar a estabilidade) ganha, perde ou compartilha elétrons. Nesse processo, surgem as ligações químicas.
Classificamos as ligações em três tipos:
- ligação iônica
- ligação covalente
- ligação metálica
Observação:
A Teoria do Octeto explica a formação de várias substâncias, mas apenas quando envolvem os elementos representativos (famílias A da Tabela Periódica). Os elementos de transição (famílias B), na maioria dos casos, não obedecem à Teoria do Octeto.
Ligação Iônica
A ligação iônica ocorre entre átomos que apresentam baixa energia de ionização e alta eletropositividade, ou seja, que apresentam grande tendência em perder elétrons (metais) e átomos de alta eletronegatividade e alta afinidade eletrônica, ou seja, que apresentam grande tendência de receber elétrons (não metais e hidrogênio).
É a ligação que ocorre quando se ligam:
|
Metal + Não Metal Ou Metal + Hidrogênio |
O átomo do metal possui, geralmente, 1, 2 ou 3 e na camada de valência e doa-os ao não metal (ou H), obtendo, com isso, 8e- na camada de valência. Ao ceder esses elétrons, transforma-se em cátion com carga +1, +2 ou +3, respectivamente.
O não metal possui 5, 6 ou 7 na camada de valência e recebe 3, 2, ou 1 do metal, respectivamente, obtendo 8e- na última camada. Com isto, sua carga vai a -3, -2 ou -1, respectivamente.
Para alcançar a estabilidade, o átomo de hidrogênio (1H ![]() 1s1) precisa receber um elétron, adquirindo a distribuição eletrônica semelhante à do Hélio (1s2).
1s1) precisa receber um elétron, adquirindo a distribuição eletrônica semelhante à do Hélio (1s2).
Exemplo
Ligação entre o sódio (Z = 11) e o cloro (Z = 17):
11Na![]() 1s2 2s2 2p6 (3s1 )
1s2 2s2 2p6 (3s1 )
metal ![]() 1 elétron na camada de valência (3s1 )
1 elétron na camada de valência (3s1 )
O Na perde 1 elétron, formando cátion monovalente:
Na + ![]() 1s2 2s2 2p6
1s2 2s2 2p6
O átomo de Na, perdendo o elétron da camada de valência, transforma-se no cátion Na+, com 8 elétrons nessa camada, portanto estável.
17Cl ![]() 1s2 2s2 2p6 (3s2 3p5 )
1s2 2s2 2p6 (3s2 3p5 )
ametal![]() 7 elétrons na camada de valência (3s2 3p5 )
7 elétrons na camada de valência (3s2 3p5 )
O Cl ganha 1 elétron, formando ânion monovalente:
Cl- ![]() 1s2 2s2 2p6 3s2 3p6
1s2 2s2 2p6 3s2 3p6
O átomo de Cl, recebendo 1 elétron na camada de valência, forma o ânion Cl- , estável, com 8 elétrons nessa camada.
Fórmula do composto é Na+Cl- ou NaCl
O número de elétrons perdidos pelo metal sempre é igual ao número de elétrons recebidos pelo não metal ou hidrogênio.
Portanto, no exemplo abaixo, na fórmula do composto temos dois íons de sódio e um de oxigênio.
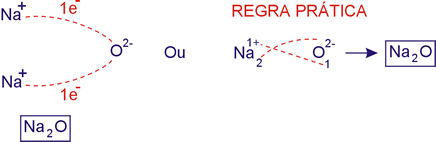
PROPRIEDADES DOS COMPOSTOS IÔNICOS
Nas condições ambientais (T = 25oC, P = 1atm), os compostos iônicos são sólidos devido à força de atração eletrostática entre cátions e ânions ser muito intensa. São duros e quebradiços.
Apresentam alto ponto de fusão, também devido à intensidade das forças de atração entre os íons. Para que um composto iônico passe para o estado líquido, as ligações iônicas devem romper-se e os íons separar-se; para isso, deve-se fornecer muita energia na forma de calor.
Exemplos de compostos iônicos:
NaCl ponto de fusão = 800oC
CaF2 ponto de fusão = 1600oC
Quando em solução aquosa (dissolvidos em água) ou fundidos (no estado líquido), os compostos iônicos apresentam íons livres e, por isso, conduzem corrente elétrica.
RESUMO
METAL: 1, 2 ou 3 e- na camada de valência: cede 1, 2 ou 3e-
![]()
CÁTION: +1, +2 ou +3
NÃO METAL: 5, 6 ou 7 e- na camada de valência: recebe 3, 2 ou 1e-
![]()
ÂNION: -3, -2 ou -1
Ligação Covalente Normal
É a ligação que ocorre quando se unem:
|
NÃO METAL + NÃO METAL NÃO METAL + HIDROGÊNIO HIDROGÊNIO + HIDROGÊNIO |
Como todos os átomos dos elementos citados têm tendência a receber elétrons, o resultado que satisfaz a todos é o compartilhamento de elétrons, que ocorre sempre aos pares. Representação do compartilhamento entre átomos A e B:
![]()
O objetivo do compartilhamento é completar o octeto da camada de valência. Ou, no caso do hidrogênio, completar o "dueto".
Cada ligação covalente normal é formada por um elétron de cada átomo (compartilhamento de um par de elétrons); como não há ganho nem perda de elétrons, os compostos formados são eletricamente neutros, e chamados de moléculas, ou compostos moleculares.
Exemplos:
Molécula de hidrogênio (H2)
1H → 1s1 → O hidrogênio, para ficar estável, precisa de 1 elétron, ou seja, ganha ou compartilha 1 elétron.
Fórmula de Lewis (eletrônica)

Fórmula estrutural de Couper (plana)
Nesse tipo de fórmula representa-se cada compartilhamento por um traço ( 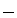 ).
).
H 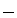 H
H
Veja a formação de algumas moléculas, a partir do número de e- da camada de valência:
1H : 1
8O : 2, 6
6C : 2, 4
17Cl: 2, 8, 7
7N : 2, 5
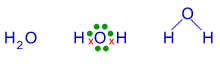
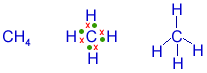
![]()
![]()
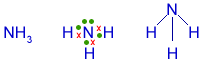
![]()
Ligação Covalente Dativa ou Coordenada
Como as moléculas não podem ser construídas, apenas com as regras dadas acima, desenvolveu-se o conceito da ligação covalente coordenada, ou ligação covalente dativa. Nela, os átomos que já possuem o octeto completo podem ligar-se “cedendo” dois elétrons não compartilhados.
Representamos assim:
![]()
Exemplo
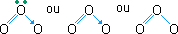
Ozônio (O3)
|
Fórmula Eletrônica
|
Fórmula Estrutural
|
Note que a ligação covalente dativa é semelhante à ligação covalente normal, já que nos dois casos está envolvido um par de elétrons.
Na ligação covalente normal o compartilhamento acontece com um elétron de cada átomo; na dativa o compartilhamento acontece com dois elétrons de um dos átomos.
Mais exemplos
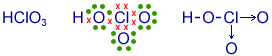
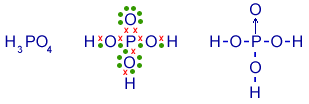
Veja a formação de algumas moléculas, a partir do número de e- da camada de valência:
1H : 1
Cl: 2, 8, 7
8O : 2, 6
P : 2, 8, 5
6C : 2, 4
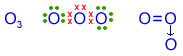

Ligação Metálica
É a ligação química entre os átomos de metais.
Os metais apresentam baixa energia de ionização e alta eletropositividade, ou seja, grande facilidade em perder elétrons da camada de valência. Assim, na ligação metálica, os átomos perdem elétrons dessa, formando cátions.
Forma-se uma quantidade muito grande de cátions envolvidos por uma quantidade enorme de elétrons livres. A ligação metálica ocorre pela atração elétrica entre os cátions (íons positivos) e os elétrons livres. Esta atração é muito intensa, o que garante o estado sólido dos metais nas condições ambiente, exceto no caso do mercúrio, o único metal líquido.
O aglomerado organizado de cátions que se forma na ligação metálica é chamado de retículo cristalino metálico.
|
A ligação metálica não é explicada pela teoria do octeto. |
Propriedades dos Metais
-
São sólidos nas condições ambiente devido à grande força de atração elétrica entre cátions e elétrons.
-
São bons condutores de corrente elétrica. O "mar de elétrons" livres é o que garante a condutividade elétrica.
-
São bons condutores de calor.
-
São maleáveis.
-
São dúcteis, isto é, com eles pode-se produzir fios.
-
Apresentam brilho metálico característico.
Ligas Metálicas
São misturas de elementos onde pelo menos um deles é metal. Exemplos: aço, lata, bronze, ouro-18, solda, etc.
Sumário
- Teoria do Octeto
- Ligação Iônica
i. Propriedades dos compostos iônicos
- Ligação Covalente Normal
- Ligação Covalente Dativa ou Coordenada
- Ligação Metálica
i. Propriedades dos Metais
ii. Ligas Metálicas
Áreas exclusivas para assinantes