Teorias ácido-base de Arrhenius
- Home
- Teorias ácido Base De Arrhenius
Ácidos de Arrehenius
É todo composto molecular que em solução aquosa sofre ionização liberando
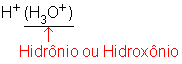
* Ionização ![]() Formação de íons
Formação de íons
Considerações Importantes
Na fórmula estrutural dos ácidos as ligações químicas são covalentes (molecular) ou seja, não há íons, mas quando dissolvemos essas substâncias em água, os íons são formados. Por isso a solução aquosa de ácido conduz corrente elétrica (eletrólito). O que caracteriza o ácido é sua propriedade de ceder H+.
![]()
O H+ liberado se liga a uma molécula de água formando ![]()
Portanto numa solução ácida não temos H+ e sim H3O+, mas como nos livros é comum a representação dessas soluções apenas por H+, dizemos:
O H+ é uma maneira cômoda de representar o H3O+.
A ionização que mostramos como exemplo:
![]()
Fica corretamente representada por:
HA + H2O ![]() H3O+ + A-
H3O+ + A-
Mas as duas são consideradas corretas.
O cátion H+ (H3O+) é responsável pelo sabor azedo das soluções ácidas. Não se deve provar os ácidos para identificá-los, pois vários deles são extremamente reativos.
A ionização acontece em etapas, onde em cada etapa ocorre a liberação de um H+ ou seja a formação de um H3O+.
Exemplo
Ácido Clorídrico (HCl) ![]() 1 Hidrogênio ionizável
1 Hidrogênio ionizável ![]() 1 etapa
1 etapa
![]()
ou
HCl + H2O ![]() H3O+ + Cl-
H3O+ + Cl-
Ácido Carbônico (H2CO3) ![]() 2 Hidrogênios ionizáveis
2 Hidrogênios ionizáveis ![]() 2 etapas
2 etapas
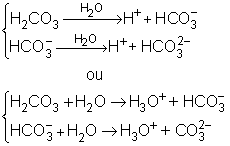
NUNCA SE ESQUEÇA: Quando aparecer H+, na verdade é o H3O+
Força dos Ácidos
Ao dissolver-se um ácido na água, algumas moléculas sofrerão ionização formando H+ (ou H3O+), outras não. Quanto maior é o número de moléculas ionizadas, mais forte é o ácido.
Nomenclatura
Hidrácidos (ácidos não oxigenados)
Ácido Nome do elemento + ÍDRICO
Exemplo
HCl : ácido clorídrico.
HF : ácido fluorídrico.
H2S : ácido sulfídrico.
HCN : ácido cianídrico.
Oxácidos (ácidos oxigenados)
A grande maioria dos ácidos apresentam oxigênio. Temos alguns caminhos para a nomenclatura desses ácidos, vamos agora por um deles.
NOME: Ácido Elemento central + ICO
TABELA DE ÁCIDOS PADRÃO
| Elemento Central | Padrão | Nome |
| Cl, Br, I | H Cl O3 | Ácido Clórico |
| S, Se, Te | H2 S O4 | Ácido Sulfúrico |
| P, As, Sb | H3 P O4 | Ácido Fosfórico |
| B | H3 B O3 | Ácido Bórico |
| C | H2 C O3 | Ácido Carbônico |
| N | H N O3 | Ácido Nítrico |
1ª REGRA
Ácido padrão com um átomo de oxigênio a menos
Ácido Elemento central + oso
Exemplo
H2SO3 ![]() Ácido sulfuroso
Ácido sulfuroso
(Veja na tabela que o ácido padrão para o enxofre é H2SO4)
2ª REGRA
Ácido padrão com dois átomos de oxigênio a menos
Ácido Hipo + elemento central + oso
Exemplo
H3PO2 ![]() Ácido Hipofosforoso
Ácido Hipofosforoso
(o ácido padrão para o fósforo é o H3PO4)
3ª REGRA
Ácido padrão com um átomo de oxigênio a mais
Ácido Per + elemento central + ico
Exemplo
HClO4 ![]() Ácido Perclórico
Ácido Perclórico
(Padrão para o cloro é HClO3)
Ácidos "orto"
Este prefixo não altera a fórmula do ácido, apenas indica que é possível retirar água.
Exemplo
Ácido ortofosfórico = Ácido Fosfórico ![]() H3PO4
H3PO4
Ácidos "meta"
Este prefixo indica que foi retirado uma molécula de água de uma molécula do ácido.
1 (ácido) -1 H2O
Exemplo
Ácido metafosfórico ![]() HPO3
HPO3
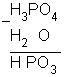
Ácidos "piro"
Este prefixo indica que foi retirado uma molécula de água de duas moléculas do ácido.
2 (ácido) - 1 H2O
Exemplo
Ácido Pirofosfórico ![]() H4P2O7
H4P2O7
2.(H3PO4) ![]()
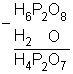
## quebra pagina ##
Indicadores Ácidos
Indicadores ácidos são substâncias que, ao entrar em contato com soluções ácidas, mudam de cor. A mudança de cor indica a presença do H+ (H3O+).
Existem vários indicadores:
- O papel de tornassol azul torna-se vermelho quando entra em contato com soluções ácidas.
- O alaranjado de metila (metil orange) torna-se róseo quando entra em contato com soluções ácidas.
Ácidos importantes
Vamos considerar os ácidos mais utilizados. É importante lembrar suas fórmulas.
HCl ![]() ácido clorídrico.
ácido clorídrico.
Vendido no comércio com o nome de ácido muriático, é utilizado, entre outros usos, em limpeza geral. É liberado pela mucosa estomacal durante a digestão, aonde atinge concentração de 0,01mol por litro.
H2SO4![]() ácido sulfúrico (ou sulfato de hidrogênio).
ácido sulfúrico (ou sulfato de hidrogênio).
É um dos mais fortes de que a química dispõe e é utilizado em inúmeros processos, sendo a substância produzida em maior quantidade no mundo.
É muito utilizado na fabricação de fertilizantes, na indústria petroquímica e na fabricação de corantes. Está presente nas baterias de automóveis.
O H2SO4 é um dos ácidos presentes na água da chuva ácida. Ela ocorre em ambientes onde o ar atmosférico está poluído, causando destruição da superfície de edifícios e de monumentos de mármore, granito, bronze e outros materiais minerais e poluindo o solo e a água de rios, lagos, mares e oceanos.
H2CO3![]() ácido carbônico ou carbonato de hidrogênio
ácido carbônico ou carbonato de hidrogênio
É o ácido presente em qualquer bebida gaseificada. O ácido carbônico (H2CO3) é uma substância altamente instável, que se transforma facilmente em gás carbônico (CO2 ) e água.
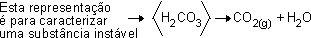
H3PO4 ![]() ácido fosfórico ou fosfato de hidrogênio
ácido fosfórico ou fosfato de hidrogênio
Utilizado para acidificar refrigerantes e xampus. É utilizado na fabricação de fertilizantes.
H2S ![]() ácido sulfídrico ou sulfeto de hidrogênio
ácido sulfídrico ou sulfeto de hidrogênio
Possui cheiro de ovo podre. É liberado por bactérias em processos de decomposição como ocorre no lixo ou na boca, onde é um dos responsáveis pelo mau hálito matinal.
H3CCOOH ![]() ácido acético
ácido acético
Ácido presente no vinagre.
Bases de Arrhenius
São compostos iônicos que em solução aquosa liberam OH- (Hidróxido ou Hidroxila)
B(OH)x 
Um composto inorgânico pode ser classificado como base ou hidróxido, identificando a presença do OH-, em sua fórmula, à direita.
|
|
NaOH
Ca(OH)2
Como as bases são compostos iônicos, quando dissolvidos em água os íons separam-se, este processo é chamado de dissociação iônica.
Veja algumas dissociações:
NaOH  Na+ + OH-
Na+ + OH-
Ca(OH)2  Ca2+ + 2OH-
Ca2+ + 2OH-
|
Na verdade temos bases iônicas e moleculares. As mais importantes, |
Bases - Formulação
Para encontrar a fórmula de uma base, considera-se que os ânions OH - devem anular as cargas do cátion.
Exemplos
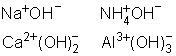
Cátions mais importantes
Valência Fixa
|
NH4+, Ag, 1A Cd, Zn, 2A Al |
Valência Variável
| METAL | VALÊNCIA |
| Cu, Hg | + 1 ou + 2 |
| Fe, Co, Ni | + 2 ou + 3 |
| Au | + 1 ou + 3 |
| Sn, Pb, Mn, Pt | + 2 ou + 4 |
Nomenclatura
Hidróxido de _________ - acrescentando-se o nome do cátion a seguir.
Exemplos
NaOH - hidróxido de sódio.
Ca(OH)2 - hidróxido de cálcio.
Al(OH)3 - hidróxido de alumínio.
NH4OH - hidróxido de amônio.
Para cátions com mais de uma valência, especifica-se esta em algarismos romanos ou usam-se as terminações:
______oso : para o de menor valência.
______ico : para o de maior valência.
Exemplos
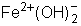 - hidróxido de ferro II ou hidróxido ferroso
- hidróxido de ferro II ou hidróxido ferroso
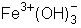 - hidróxido de ferro III ou hidróxido férrico
- hidróxido de ferro III ou hidróxido férrico
Propriedades das Bases de Arrehenius
O OH- (hidroxila) em solução aquosa é responsável pelas propriedades características das bases:
- sabor adstringente (amarra na boca);
- deixa a pele lisa e escorregadia.
Indicadores de Bases
Os indicadores de ácidos, também são indicadores se bases. Na verdade, são chamados de indicadores ácido-base.
A fenolftaleína é uma solução que, ao entrar em contato com soluções básicas, torna-se vermelha e em contato com ácidos, é incolor. A fenolftaleína está presente em comprimidos do laxante lacto-purga. Um outro indicador ácido-base é uma substância presente nas folhas do repolho roxo.
Força de Bases
Nem todos os íons-fórmula - B(OH)x - da base que está dissolvida em água, dissociam-se em Bx+ + XOH-. Quanto maior é a capacidade da base dissociar-se, produzindo íons OH-, tanto mais forte será.
Bases fortes: São os hidróxidos dos metais dos grupos IA e IIA: NaOH, KOH, Ca(OH)2, Ba(OH)2 , etc.
Bases fracas: As demais: NH4OH, Al(OH)3 Fe(OH)3
Química Aplicada
NaOH - hidróxido de sódio: Uma das substâncias consumidas em maior quantidade no mundo todo. É utilizada em limpeza doméstica pesada, para fabricar sabão, etc. Nome usual: soda cáustica.
Mg(OH)2 - hidróxido de magnésio: Em suspensão aquosa é comercializada como leite de magnésia, um antiácido estomacal e laxante suave.
Al(OH)3 - hidróxido de alumínio: É utilizado em medicamentos antiácidos.
Ca(OH)2 - hidróxido de cálcio: Também conhecido como cal hidratada, é usado na preparação da massa dos pedreiros (areia + cimento + cal hidratada + água). A cal hidratada, Ca(OH))2 , também é usada na caiação (pintura a cal).
NH4OH - hidróxido de amônio: É o amoníaco. Usado em limpeza doméstica e na produção de fertilizantes. É uma base que se decompõe, liberando o gás amônia (NH3).
NH4OH 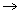 NH3 + H2O
NH3 + H2O
Potencial Hidrogeniônico (pH)
A escala de pH vai de 0 a 14. A medida do pH permite identificar se uma solução é ácida, básica (alcalina) ou neutra.
O método mais simples de se determinar o pH de uma substância é a utilização do chamado indicador universal: uma fita de papel onde há uma mistura de vários indicadores ácido-base. A coloração do indicador universal sempre muda quando em contato com alguma solução. Na embalagem desse tipo de indicador, há uma escala de cores associadas ao pH de soluções.
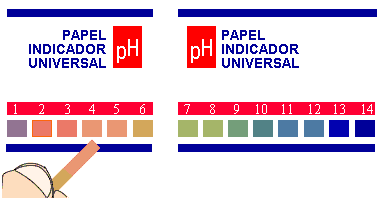
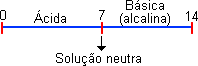
pH = 7 - solução neutra.
pH < 7 - solução ácida - quanto menor o pH, mais ácida a solução.
pH > 7 - solução básica - quanto maior o pH, mais básica a solução.
Exemplos:
Café pH = 5
Solução de bateria (solução aquosa de ácido sulfúrico): pH = 1
O pH das duas soluções é menor que 7, indicando que ambas são soluções ácidas. A solução de bateria apresenta pH mais baixo, portanto é mais ácida que o café.
Exemplos:
Sabonete: pH = 10
Limpa forno: pH = 13
O pH dos dois produtos é maior que 7; portanto, são ambos básicos. O limpa-forno tem pH maior; portanto, é mais básico que o sabonete.
A tabela abaixo mostra o valor do pH de substâncias usadas no nosso cotidiano.

Lembre-se:
diminuição do pH - a solução torna-se mais ácida (ou menos básica).
aumento do pH - a solução torna-se menos ácida (ou mais básica).
Sumário
- Ácidos de Arrehenius
i. Considerações Importantes
ii. Força dos Ácidos
- Nomenclatura
i. Hidrácidos (ácidos não oxigenados)
ii. Oxácidos (ácidos oxigenados)
iii. Ácidos "orto"
iv. Ácidos "meta"
v. Ácidos "piro"
- Indicadores Ácidos
- Ácidos importantes
- Bases de Arrehenius
- Bases - Formulação
- Nomenclatura
- Propriedades das Bases de Arrehenius
- Indicadores de Bases
- Força de Bases
- Química Aplicada
- Potencial Hidrogeniônico (pH)
Áreas exclusivas para assinantes





