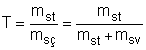Soluções - Estados físicos das soluções
- Home
- Soluções Estados Físicos Das Soluções
Soluções - Estados físicos das soluções
Solução é toda mistura homogênea.
SOLUÇÃO LÍQUIDA
Exemplo 1
Água mineral, onde temos sais minerais dissolvidos em água.
SOLUÇÃO SÓLIDA
Quando simplesmente colocamos sólidos diferentes em um recipiente, temos uma mistura heterogênea. Mas, se utilizarmos alguns processos, podemos obter uma mistura homogênea.
Exemplo 2
O ouro de 18 quilates é uma solução que apresenta 75% de ouro (Au) e 25% de cobre (Cu).

SOLUÇÃO GASOSA
A mistura de quaisquer gases em quaisquer quantidades é sempre homogênea. Portanto uma mistura de gases é sempre uma solução, como o ar atmosférico das montanhas, que é constituído principalmente de nitrogênio (N2) e de oxigênio (O2 ).

Obs: Nas regiões onde há tráfego de carros, ônibus e caminhões e nas regiões industriais, no ar atmosférico encontra-se a fuligem (C(s)) que são pequenas partículas de carvão que ficam em suspensão no ar. Trata-se de uma mistura heterogênea.
Quando dizemos que a mistura é homogênea, significa que em todos os pontos da solução há as mesmas quantidades das substâncias, perfeitamente distribuídas.
Exemplo 3
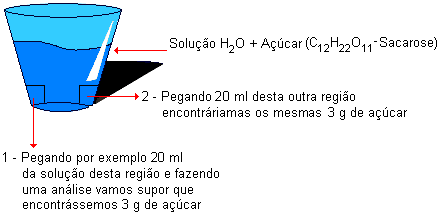
Pegue um copo com água e dissolva uma quantidade qualquer de açúcar. Depois do açúcar totalmente dissolvido, tome esta água adocicada com um canudo, de pontos diferentes da solução. Você sentirá, em todos os pontos, o mesmo sabor adocicado. Isto é uma mistura homogênea.
Supondo que no copo você dissolveu 20g de açúcar.
|
Quando uma receita pede para “homogeinizar”, isto quer dizer para garantir que todos pontos do alimento tenham o mesmo sabor. |
Concentração de Soluções
A concentração determina a quantidade de substâncias presentes na solução.

A massa da solução é a massa do soluto somada à do solvente:
msç = mst + msv
soluto = st
solvente = sv
solução = sç
Exemplo 4
Ouro 18 quilates
Concentração → % em massa
→ % em massa
Isto significa que em um anel de ouro 18 quilates de 10g, 75% do mesmo, ou seja, 7,5g, é de ouro e 2,5 (25%) de cobre.
Ou uma barra de 1,0 Kg de ouro 18 quilates contém 750 g de ouro (75%) e 250 g de cobre (25%).
Exemplo 5
![]()
N2(g) ![]() 78%
78%
O2(g) ![]() 21%
21%
Outros gases ![]() 1%
1%
Em cada litro ( 1000 ml ) de ar, temos:
780 ml de N2
210 ml de O2
10 ml de outros gases
1 L = 1000 ml
Exemplo 6
Álcool Hidratado 96º GL ( % em volume ) 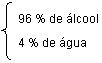
Em cada litro de álcool, temos 0,96l (960ml) de álcool e 0,04l ( 40 ml de água ).
DETERMINAÇÃO DA CONCENTRAÇÃO
1) Título ( T )
É a forma de concentração que expressa a porcentagem, em massa ou volume, das substâncias contidas na solução.
Exemplo 7
Vinagre : Veja que no rótulo está escrito: Fermentado acético (ácido acético) a 4,0%.
| Solução aquosa (aq) = dissolvida em água Aquosa |
Isto significa que em qualquer quantidade de vinagre, 4% do mesmo é constituída por ácido acético.
Ou seja:
Se você usar 100g de vinagre, 4g (4%) é ácido acético; se forem 10g de vinagre, 0,4g (4%) é ácido acético.
Exemplo 8
Soro fisiológico: 0,9% NaCl (a q.). Ou seja, em 1.000g (1 Kg) de soro fisiológico, temos 9g de NaCl.
Portanto, para calcular o título (T) de uma solução, basta determinar a porcentagem do soluto (substância dissolvida) contido na solução.
Exemplo 9
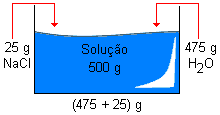
Qual é o título de uma solução de água sanitária, que foi preparada pela adição de 25g de hipoclorito de sódio ( NaClO) em 475g de água?
| NaClO |
500 g ![]() 100%
100%
25 g ![]() X%
X%
X = 5%
Esta água sanitária é de 5% em hipoclorito de sódio.
Exemplo 10
Um produto limpa-forno, usado para remover gorduras, é uma solução aquosa de soda cáustica (NaOH) a 20%. A embalagem traz a informação: peso líquido 200g.
Pergunta-se:
a) Qual é a massa de soda cáustica presente no frasco?
200 g ______ 100%
X ______ 20%
X = 40 g
| Peso líquido = está descontado o peso da embalagem |
b) Ao utilizar 10g do produto, qual a massa de soda cáustica utilizada?
10 g ______ 100 %
y ______ 20 %
y = 2g
| Lembre-se: qualquer massa de uma solução contém 20% de soda cáustica |
2) Concentração
Expressa a massa dissolvida em certo volume (ml, L, m3) de solução.
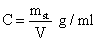
mst = massa do soluto em gramas
V = volume da solução em litros
Exemplo 11
Dissolvendo 20 g de açúcar em água, obtendo 500ml de solução.
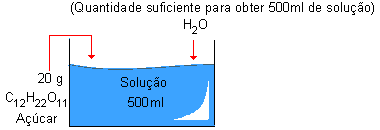
Temos 20 g de C12 H22 O11, dissolvidos em 500 ml de solução.
Vamos expressar em g/L (gramas por litro)
20 g ![]() 0,5 L (500 ml)
0,5 L (500 ml)
X ![]() 1,0 L (1000 ml)
1,0 L (1000 ml)
| X = 40g/L → | Interpretação: Em 1,0L desta solução temos 40g de C12H22O11 dissolvidos. |
Exemplo 12
Foi determinada a quantidade de enxofre (SO2) em certo local de São Paulo. Em 2,5m3 de ar foram encontrados 220 μg de SO2. Qual a concentração de SO2, expressa em μg / m3?
μg /m3 → microgramas de SO2 em 1 m3 de ar.
| μ = micro (10-6) |
220 μg SO2 _________ 2,5 m3 de ar
| μg = micrograma = 10-6g |
X _________ 1,0 m3 de ar
| m3 = metro cúbico= 1000L |
X = 88 μg/m3
Exemplo 13
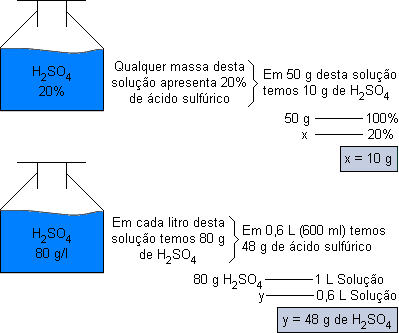
Quando entramos em um laboratório, vemos vários frascos devidamente etiquetados. Nestas etiquetas constam a fórmula ou o nome da substância, dissolvida geralmente em água (solução aquosa) e sua concentração.
Exemplo 14
Observe a bula abaixo:

- Qual a massa de paracetamol no frasco de notuss de uso adulto?
- Na bula temos, para cada ml, 50mg de paracetamol.
- O frasco tem 120 ml.
1 ml _______ 50 mg de paracetamol
120 ml ______ X
X = 6000 mg mili (m) = 10-3
X = 6g
- Para uma criança de 2 a 6 anos, em cada dose recomendada qual é a massa de dropropizina?
- Na bula, cada ml de xarope, contém 1,5 mg de dropropizina.
- Dose ( 2 a 6 anos ) - 2,5 ml
1 ml _______ 1,5 mg de dropropizina
2,5 ml ______ X
X = 3,75 mg de dropropizina
- Supondo que uma criança de 8 anos necessita deste medicamento, mas o mesmo só está disponível na formulação de uso adulto (cuja dose recomendada é de 15ml),No entanto, para a criança, a dose recomendada é de 5ml do medicamento de uso pediátrico. Será correto, como precisamos de ![]() do volume, utilizar o medicamento de uso adulto e dar a dosagem recomendada para o uso pediátrico?
do volume, utilizar o medicamento de uso adulto e dar a dosagem recomendada para o uso pediátrico?
Perceba:
|
|
p/ cada ml
|
||||||
| Paracetamol |
50 mg
|
|
Pegando
Pegaremos
|
|
Paracetamol
|
16,66 mg
|
|
|
Cloridrato de difenidramina
|
3 mg
|
Cloridrato de difenidramina
|
1 mg
|
||||
|
Cloridrato de Pseudoefedrina
|
3 mg
|
Cloridrato de pseudoefedrina
|
1 mg
|
||||
|
Droproprizina
|
3 mg
|
Dropropizina
|
1 mg
|
||||
Observe que, no uso pediátrico, a bula determina para cada ml:
| Uso Pediátrico | |
| Para cada ml | |
| Paracetamol - 12mg | No cálculo que fizemos, teríamos 16,66mg deste composto; portanto está em quantidade excessiva |
| Cloridrato de difenidramina - 1,5mg | No cálculo que fizemos, teríamos 1mg deste composto; portanto, está em quantidade insuficiente. |
| Cloridrato de Pseudoefedrina - 1,5 mg Dopropizina - 1,5 mg | Como no composto anterior, teríamos quantidade insuficiente de medicamento. |
Fazendo desta forma, concluímos que todas as quantidades seriam administradas de maneira inadequada: uma em excesso e, as outras três, em quantidades insuficientes. Portanto o medicamento não teria a ação desejada. Em casos similares, compre o medicamento correto ou pergunte ao médico se o procedimento acima pode ser usado. Lembre-se que não se brinca com medicamentos!
Sumário
- Solução Líquida
- Solução Sólida
- Solução Gasosa
- Concentração de Soluções
- Determinação da Concentração
1) Título ( T )
2) Concentração
Áreas exclusivas para assinantes