Sais - Nomenclatura dos Sais
- Home
- Sais Nomenclatura Dos Sais
Reação de salificação ou neutralização
Sal é todo o composto que, em solução aquosa, libera pelo menos um cátion diferente de H+ e um ânion diferente do OH-. Em outras palavras, sal é o produto da reação entre um ácido e uma base.
Esta é denominada reação de salificação ou neutralização:
ÁCIDO + BASE → SAL + ÁGUA
Exemplos
HCl + NaOH → NaCl + H2O
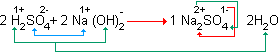
H2SO4 + 2NaOH → Na2SO4 + 2H2O
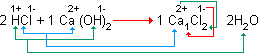
3H2SO4 + 2Al(OH)3 → Al2(SO4)3 + 6H2O
REPRESENTAÇÃO GENÉRICA
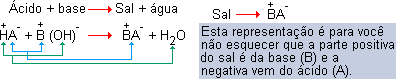
|
Para determinar a fórmula correta do sal, é necessário saber as cargas dos cátions e ânions. |
Vamos ver outros exemplos:
NOMENCLATURA DOS SAIS
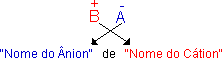
O ânion do sal é sempre proveniente do ácido, e para determinar seu nome basta fazer a troca de sufixo com o ácido de origem de acordo com o quadro:
| ÁCIDO | ÂNION |
| ídrico | eto |
| ico | ato |
| oso | ito |
Exemplos
NaCl: cloreto de sódio
( do HCl: ácido clorídrico)
CaSO4 : sulfato de cálcio
( do H2SO4: ácido sulfúrico)
NH4NO3: nitrato de amônio
( do HNO3: ácido nítrico)
Fe3(PO4)2 : fosfato de ferro II
( H3PO4: ácido fosfórico)
DISSOCIAÇÃO DOS SAIS
Sais dissociam-se em água liberando cátions e ânions.
Exemplos
NaCl → Na+ + Cl-
Na2SO4 → 2Na+ + SO42-
PRINCIPAIS SAIS
NaCl → cloreto de sódio: É o sal de cozinha comum. Está presente no soro fisiológico (H2O + açúcar + NaCl) que é tão importante no combate à desidratação.
NaHCO3 → bicarbonato de sódio (hidrogeno carbonato de sódio). Está presente nos medicamentos efervescentes.
É um componente fundamental dos fermentos. Com o aquecimento, o bicarbonato de sódio se decompõe, produzindo gás carbônico (CO2), que exerce pressão nas paredes da massa (de pães, bolos etc), promovendo seu crescimento.
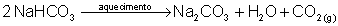
Na NO3 → nitrato de sódio: É o salitre. Utiliza-se na fabricação da pólvora ordinária, pois decompõe-se com o calor produzindo oxigênio:
CaSO4 → sulfato de cálcio. Dependendo da forma de cristalização pode ser denominado gesso (giz), gipsita etc.
Ca CO3 → carbonato de cálcio é o principal constituinte do mármore e do calcário.
Comentários Importantes
As bases reagem e neutralizam os ácidos, formando sais e água. É por isso que as bases são chamadas de antiácidos. De todos os antiácidos existentes nas farmácias, o mais famoso é o leite de magnésia, que é constituído de hidróxido de magnésio (Mg(OH)2), uma base.
No estômago há vários ácidos (suco gástrico); dentre eles, o que aparece em maior concentração é o ácido clorídrico (HCl). A gastrite, aquela queimação no estômago, é causada por uma acidez excessiva. Para acabar com esta queimação, é preciso neutralizar o excesso de ácido: toma-se um antiácido (uma base).
Ao ingerir o leite de magnésia, a reação que ocorre no estômago é representada pela equação:
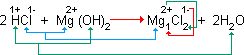
O hidróxido de magnésio reage – neutraliza o ácido – produzindo sal e água.
UM CONCEITO MUITO IMPORTANTE!
Se há uma solução ácida, para neutralizá-la, é adicionada uma base.
Se há uma solução básica, para neutralizá-la, é adicionado um ácido.
Uma das etapas de tratamento do solo para o plantio é a calagem, que consiste na adição à terra de substâncias alcalinas (básicas) para diminuir a acidez do solo. Uma das substâncias utilizadas para neutralizar ácidos presentes na terra é a cal hidratada (Ca(OH)2). A calagem é feita para aumentar o pH do solo.
Sumário
- Reação de salificação ou neutralização
- Nomenclatura dos Sais
- Dissociação dos Sais
- Principais Sais
- Um conceito muito importante!
Áreas exclusivas para assinantes





