Óxidos - Nomenclatura dos óxidos
- Home
- Óxidos Nomenclatura Dos óxidos
Óxidos - Nomenclatura dos óxidos
Óxidos são compostos binários onde o elemento mais eletronegativo (da direita) é o oxigênio.
ExOy
a) Óxidos iônicos: São formados pelo ânion óxido (O2-) e um cátion de metal.
b) Óxidos covalentes: São formados por um não metal e o oxigênio.
Nomenclatura e Formulação
Para encontrar a fórmula de um óxido iônico, levamos em conta que a carga dos cátions deve anular a carga dos ânions O2-. Para a nomenclatura, o mais usual é:
óxido + nome do cátion:
Exemplo
Na2O: óxido de sódio
CaO: óxido de cálcio
Al2O3: óxido de alumínio
Fe2O3: óxido de ferro III ( ou férrico)
A nomenclatura dos óxidos covalentes é feita usando-se os prefixos mono, di, tri, tetra ... para indicar o número de oxigênios e de átomos do elemento que o acompanha. O prefixo mono no segundo elemento é opcional. Cada elemento pode formar diversos óxidos:
Exemplo
NO: monóxido de (mono)nitrogênio.
NO2: dióxido de nitrogênio.
N2O: monóxido de dinitrogênio.
N2O3 : trióxido de dinitrogênio.
N2O5 : pentóxido de dinitrogênio.
Classificação dos Óxidos
Óxidos ácidos - são óxidos moleculares (constituídos exclusivamente de ligações covalentes) que reagem com água, formando ácidos.
Óxidos neutros ou indiferentes - são óxidos (constituídos de ligações covalentes) que não reagem com água.
Química aplicada
Óxido de cálcio (CaO): É comercializada como cal virgem. Usada no preparo de argamassa e em pintura.
Óxido Férrico (Fe2O3): É a hematita. Um importante minério de ferro.
Óxido de alumínio (Al2O3): É o principal componente da bauxita (minério de alumínio).
Dióxido de enxofre (SO2) e trióxido de enxofre (SO3): Óxidos ácidos produzidos na queima de combustíveis fósseis.
Por serem óxidos ácidos, assim que entram em contato com a água, produzem ácidos.
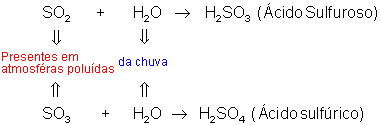
Dióxido de nitrogênio: É um óxido ácido presente em qualquer atmosfera, poluída ou não.
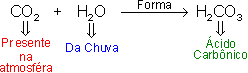
Dióxido de carbono (CO2): É o gás carbônico. Liberado na respiração e em combustões. Provoca o "efeito estufa".
Em ambientes não poluídos, na ausência de raios e relâmpagos, o CO2 é o responsável pela acidez da chuva, pois se trata de óxido ácido.
Veja a reação:
Em ambientes poluídos, há excesso de gás carbônico na atmosfera; isso é devido à quantidade muito grande de veículos motorizados e de diversas indústrias.
Monóxido de carbono (CO): é um importante poluente liberado pelos motores de combustão, principalmente a gasolina. Reage com a hemoglobina do sangue.
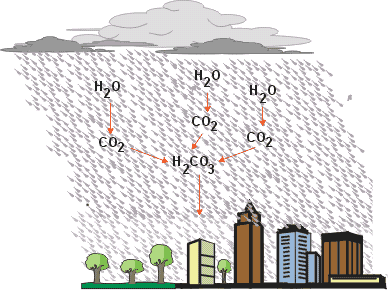
Chuva ácida
A chuva é naturalmente ácida porque o CO2 reage com a água produzindo ácido carbônico, um ácido muito fraco. Em locais poluídos com SO2, SO3 e NO2, estes reagem com a água da chuva produzindo ácidos fortes como H2SO4 (ácido sulfúrico) e HNO3 (ácido nítrico).
Sumário
- Nomenclatura e Formulação
- Classificação dos Óxidos
- Química aplicada
i. Chuva ácida
Áreas exclusivas para assinantes





