O que é Química
- Home
- O Que é Química
Por volta do ano 400 a. C, dois filósofos gregos, Demócrito e Leucipo, propuseram uma teoria referente à natureza da matéria. Se dividíssemos qualquer material e o quebrássemos sempre em menores pedaços, chegaríamos a um ponto em que o fragmento remanescente seria tão pequeno, que não seria mais possível dividi-lo. Este fragmento indivisível eles denominaram de átomo.
Hoje sabemos que o átomo é divisível, mas sabemos também que Demócrito e Leucipo estavam corretos em acreditar que toda matéria é constituída de partículas extremamente pequenas.
|
Á
|
TOMO |
| não | divisível |
A confirmação de que o átomo é divisível ocorreu no final do século XIX (1887), através da descoberta do elétron pelo cientista inglês Joseph John Thomson.
O conceito de átomo surgiu pela primeira vez por volta do ano 400 a.C, mas somente no final do século XIX ficou comprovado que o átomo poderia ser dividido. Portanto, durante aproximadamente dois milênios, a palavra átomo foi usada para designar o elemento básico que constitui toda a matéria. Hoje em dia continuamos a utilizar o termo átomo (“não divisível”), mesmo sabendo que ele é divisível.
Sabe-se que um átomo tem diâmetro de aproximadamente 10-8 cm.
| 10-8 cm = | 1 /(1 . 108) | cm = | 1/100.000.000 | cm |
|
↓ |
||||
Vamos comparar:
Medindo-se 1 cm e dividindo-o em 10 partes iguais temos um milímetro, mostrado na régua abaixo.
| 1 /10 | cm | = 1 mm |
|
↓
|

Para se ter uma ideia do tamanho do átomo , ![]() , teríamos que medir 1 cm e dividi-lo em 100 milhões de partes exatamente iguais.
, teríamos que medir 1 cm e dividi-lo em 100 milhões de partes exatamente iguais.
|
Matéria |
Toda matéria é constituída de átomos. Mas, se o átomo é tão pequeno, como conseguimos enxergar as coisas? A matéria é constituída por um agrupamento gigantesco de átomos.
Até hoje foram descobertos pouco mais de 100 átomos; a combinação entre eles é o que forma as moléculas. A mais famosa molécula, e uma das mais importantes, é a água, representada pelo símbolo H2O. Ou seja, uma molécula de água é o resultado da combinação de dois átomos de hidrogênio e um átomo de oxigênio. Cada molécula de água é constituída por três átomos, mesmo que estes não sejam visíveis a olho nu.
O que enxergamos é o agrupamento de um número muito grande de moléculas, denominadas de substância.
Uma constatação:
O sal de cozinha, cloreto de sódio, é representado pela fórmula NaCl. Em cada 10g deste sal, temos por volta de 200 sextilhões de íons, 100 sextilhões de sódio e 100 sextilhões de cloro, todos agrupados. Quando dissolvemos o sal na água, ocorre uma separação, íon a íon, em partículas tão pequenas que não conseguimos enxergar; daí a impressão do sal ter desaparecido na água.
|
Íon |
Exemplo
Na → átomo de sódio
Na+ → Íon de sódio
No exemplo acima, falamos de 200 sextilhões de íons em apenas 10g de sal. Mas quanto representa 200 sextilhões?
Se começarmos a contar e levarmos um segundo para contar cada número, quanto tempo levaria para chegar a 200 sextilhões?
Observem: em cada hora temos 3.600 segundos, portanto num dia temos 3.600 . 24 = 86.400 segundos. Em um ano → 86.400 . 365 = 31.536.000 (trinta e um milhões, quinhentos e trinta e seis mil).
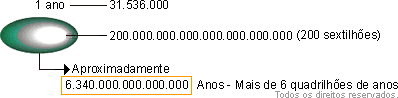
Este exemplo demonstra, mais uma vez, como o átomo é minúsculo, e que há um número incomensurável de átomos agrupados em toda e qualquer matéria que enxergamos.
|
A Química é a ciência que estuda a constituição da matéria e suas transformações. Também estuda os átomos, isoladamente, e como se unem, uns aos outros, para formar substâncias. Outro aspecto estudado pela Química é como as substâncias se transformam na presença de outras analisando todos os tipos de energia envolvidos no processo químico. |
|
Energia |
Tudo o que tem massa é matéria, e toda matéria é constituída por átomos; portanto, toda matéria é química.
O ar, os alimentos, os medicamentos, as roupas e o nosso corpo são todos constituídos por produtos químicos.
Popularmente, por pura falta de conhecimento, a química é tratada como alguma coisa nociva. Acredita-se que tudo que tem química faz mal à saúde.
Quando lemos a embalagem de um sorvete vemos que está escrito: "colorido e aromatizado artificialmente", podemos pensar que o alimento “só contém química”, já que muitas pessoas têm a ideia de que "química" é necessariamente prejudicial à saúde.
Na televisão, vemos propagandas de produtos naturais e o apresentador é enfático: “não tem contraindicação, pois não tem química; o produto é 100% natural”.
Acredita-se que
- Produto artificial = produto químico = nocivo à saúde.
- Produto natural = não é produto químico = não faz mal à saúde.
Mas estudamos nesta aula que tanto o produto natural, como o produto artificial, tem massa; ambos são matéria e, portanto, ambos são constituídos por produtos químicos.
Vamos tratar a Química de forma correta e justa!
|
Produto químico → Qualquer matéria, independente de fazer bem ou mal à saúde. |
As definições corretas são:
|
Natural → Retirado diretamente da natureza. Artificial → Produzido no laboratório. |
Há produtos naturais que fazem bem à saúde, como as verduras, frutas e substâncias extraídas desses vegetais; por outro lado, o cigarro também é um produto natural, produzido a partir de plantas, mas sabemos que é muito prejudicial à saúde.
Há produtos artificiais que também fazem bem à saúde: os medicamentos, por exemplo, desde que sejam administrados no momento certo e na quantidade correta. É a má utilização de produtos artificiais que os torna tão prejudiciais.
Vejamos alguns exemplos de produtos químicos que estão ao nosso redor:
- Produtos Eletrônicos
- Frutas / Legumes
- Sorvestes / Carnes
- Medicamentos
- Alimentos





