Mol e massa molar
- Home
- Mol E Massa Molar
Mol e massa molar
MOL
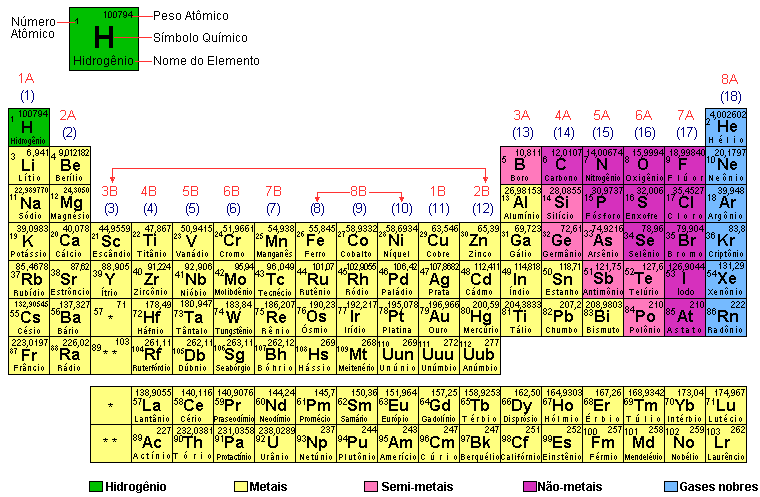
Os átomos e as moléculas, como já sabemos, são extremamente pequenos. Um agrupamento deles, deve corresponder a uma quantidade muito grande de partículas. Esse agrupamento é chamado de mol ou número de Avogadro e corresponde a 6 . 1023 partículas (600 sextilhões de partículas).
MASSA MOLAR
Massa molar é a massa de 1 mol de partículas, ou a massa de 6 . 1023 partículas.
A massa molar dos átomos é a massa atômica indicada na tabela periódica acompanhada da unidade “grama”.
Exemplos
| ELEMENTO | MASSA ATÔMICA | MASSA MOLAR | Nº DE ÁTOMOS |
| Hidrogênio | 1,008u | 1,008 g/mol | 6 . 1023 |
| Oxigênio | 16,00 u | 16,00 g/mol | 6 . 1023 |
| Enxofre | 32,06 u | 32,06 g/mol | 6 . 1023 |
Para resolução de exercícios podemos, então, fazer a relação:
Exemplo
O número de átomos de ferro (Fe = 55,847 ou 56, aproximado) em 2,3 g desse metal é:
1 mol de átomos ---------- 6 . 1023 átomos --------- 56 g
x átomos -------------- 2,3 g
x = 2,46 . 1022 átomos de ferro
6,02 . 1023 também é denominado número de Avogadro.
MASSA MOLAR DAS SUBSTÂNCIAS
A massa molar, será a massa de 1 mol (6,0 x 1023) de moléculas, íons, fórmula, etc. A massa molar das moléculas de uma substância, por exemplo, é a massa molecular expressa em gramas. Essa massa já foi denominada molécula-grama.
Exemplos
| Substância | Massa Molecular | Massa Molar | Nº de Moléculas |
| Água | 18u | 18 g/mol | 6,0 x 1023 |
| Gás carbônico | 44u | 44 g/mol | 6,0 x 1023 |
Podemos dizer, ainda, que 1 mol de uma substância gasosa ocupa nas CNTP (Condições Normais de Temperatura e Pressão) o volume aproximado de 22,4 L.
Resumindo
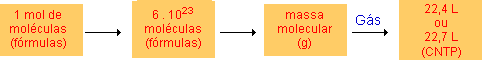
Exemplo 1
Se quisermos o número de mols de 22 g de CO2 (C = 12, O = 16), por exemplo:
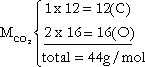
1 mol de moléculas ------- 6 . 1023 moléculas ------ 44 g ------ 22,4L (CNTP)
x --------------------------------------------------------- 22 g
x = 0,5 mol
Ou seja: 3 . 1023 moléculas de CO2
Ou
11,2 L de CO2 nas CNTP

Exemplo 2
A ureia apresenta a fórmula CO (NH2)2 . Para uma amostra que apresenta 2,4 . 1023moléculas desta substância, calcule:
a) o número de mols de ureia.
b) a massa de ureia.
Resolução
inicialmente, verificamos as quantidades referentes a 1 mol de ureia.
Da tabela periódica, temos: C = 12, O = 16, N = 14, H = 1
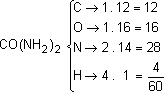
1 mol ______ 60 g ______ 6 . 1023 moléculas de ureia.
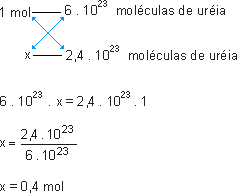
a)
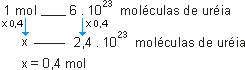
ou
Ou ainda:
|
Como o número de moléculas de 1 mol foi multiplicado por 0,4, o número de mols também será; portanto, são 0,4 mol de ureia. |
b)
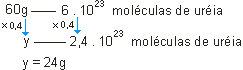
ou

Ou ainda:
O número de moléculas de ureia corresponde ao número de moléculas de 1 mol multiplicado por 0,4; a massa também deve ser multiplicada por 0,4:
60g · 0,4 = 24g
Exemplo 3
Um dos carboidratos mais importantes é a glicose (C6 H12 O6).
Para 0,3 mol desta substância, calcule:
a) a massa de glicose.
b) o número de moléculas.
Resolução
inicialmente, verificamos as quantidades referentes a 1 mol de glicose.
Na tabela periódica temos: C = 12, H = 1, O = 16.
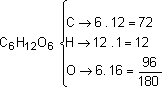
1 mol de glicose_____ 180g _____ 6 . 1023 moléculas de glicose.
a)
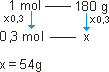
ou
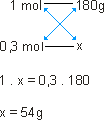
Ou ainda:
|
Como o número de mols foi multiplicado por 0,3, a massa de 1 mol também deve ser multiplicada por 0,3; logo: x = 54 g. |
b)
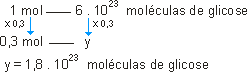
ou
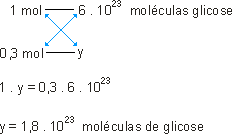
Ou ainda:
O número de mols foi multiplicado por 0,3. O número de moléculas sofre a mesma operação, portanto: 1,8 . 1023 moléculas de glicose.
Sumário
- Mol- Massa molar
- Massa molar das substâncias
Áreas exclusivas para assinantes