Glicídios, Lipídios e Proteínas
- Home
- Glicídios, Lipídios E Proteínas
Glicídios
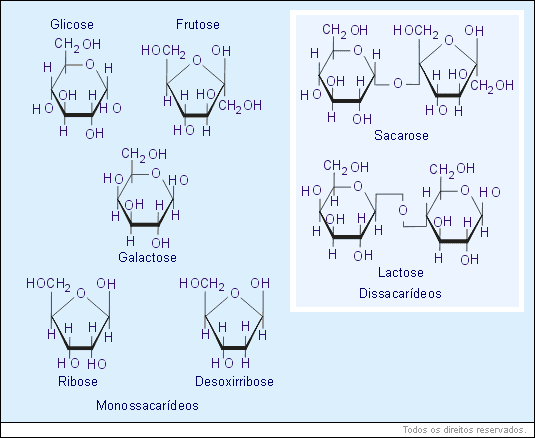
Os glicídios são também conhecidos como açúcares, sacarídeos, carboidratos ou hidratos de carbono. São moléculas compostas principalmente de: carbono, hidrogênio, oxigênio. Os açúcares mais simples são os monossacarídeos, que apresentam fórmula geral (CH2O)n. O valor de n pode variar de 3 a 7 conforme o tipo de monossacarídeo. O nome do açúcar é dado de acordo com o número de átomos de carbono da molécula, seguido da terminação OSE. Por exemplo, triose, pentose, hexose. São monossacarídeos importantes: glicose, frutose, galactose, ribose e desoxirribose.
|
n |
Fórmula |
Nome |
|
3 |
C3H6O3 |
Triose |
|
4 |
C4H8O4 |
Tetrose |
|
5 |
C5H10O5 |
Pentose |
|
6 |
C6H12O6 |
Hexose |
|
7 |
C7H14O7 |
Heptose |
A junção de dois monossacarídeos dá origem a um dissacarídeo. Exemplo: sacarose.
Quando temos muitos monossacarídeos ligados, ocorre a formação de um polissacarídeo, tal como o amido, o glicogênio, a celulose, a quitina, etc.
Os glicídios são a fonte primária de energia para as atividades celulares, podendo também apresentar funções estruturais, isto é, formar estruturas celulares. Enquanto as plantas produzem seus próprios carboidratos, os animais incorporam-nos através do processo de nutrição.
| (conjunto das transformações químicas) | ||||
|
Anabolismo - reações químicas de síntese, que "juntando"moléculas simples produzem moléculas maiores Catabolismo - reações químicas de análise (decomposição) que "quebrando" moléculas grandes separam suas unidades menores |
|||
Tabela - Monossacarídeos
|
Carboidrato |
Papel biológico |
|
|
Pentoses |
Ribose |
Uma das matérias-primas necessárias à produção de ácido ribonucleico (RNA). |
|
Desoxirribose |
Matéria-prima necessária à produção de ácido desoxirribonucleico (DNA). |
|
|
Hexoses |
Glicose |
É a molécula mais usada pelas células para obtenção de energia. É fabricada pelas partes verdes dos vegetais, na fotossíntese. Abundante em vegetais, no sangue, no mel. |
|
Frutose |
Outra hexose, também com papel fundamentalmente energético. |
|
|
Galactose |
Um dos monossacarídeos constituinte da lactose do leite. Papel energético. |
Tabela - Dissacarídeos e Polissacarídeos
|
Carboidrato |
Monossacarídeos |
Onde é encontrado e papel biológico |
|
|
DISSACARÍDEOS |
Sacarose |
glicose + frutose |
Em muitos vegetais. Abundante na cana-de-açúcar e na beterraba. Papel energético. |
|
Lactose |
glicose + galactose |
Encontrado no leite. Papel energético. |
|
|
Maltose |
glicose + glicose |
Encontrado em alguns vegetais. Provém da digestão do amido no tubo digestivo de animais. Papel energético. |
|
|
POLISSACARÍDEOS |
Amido |
muitas moléculas de glicose |
Encontrados em raízes, caules e folhas. O excesso de glicose produzido na fotossíntese é armazenado sob forma de amido. |
|
Celulose |
muitas moléculas de glicose |
Componente esquelético da parede de células vegetais, funcionando como reforço. É o carboidrato mais abundante na natureza. |
|
|
Glicogênio |
muitas moléculas de glicose |
Encontrado no fígado e nos músculos. Constitui a reserva energética dos animais. |
Lipídios
A principal propriedade dos lipídeos é o fato de serem insolúveis em água. Essas substâncias são formadas por C, H e O, mas em proporções diferentes da dos carboidratos.
Fazem parte deste grupo as gorduras, os óleos, as ceras e os esteroides. As gorduras e os óleos formam o grupo dos triglicerídeos, pois, por hidrólise, ambos liberam um álcool chamado glicerol e 3 "moléculas" de ácidos graxos. O ácido graxo pode ser saturado ou insaturado. O saturado é aquele onde há somente ligações simples entre os átomos de carbono, como por exemplo, o ácido palmítico e o ácido esteárico. O ácido graxo insaturado possui uma ou mais ligações duplas entre os carbonos, como, por exemplo, o ácido oleico.
R = 10 ou mais átomos de carbono.
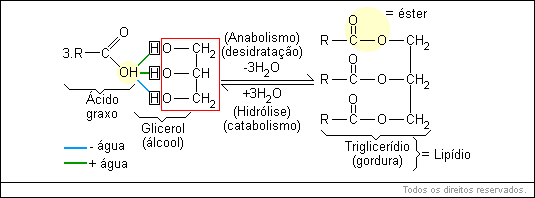
Um lipídio é chamado "gordura" quando está no estado sólido à temperatura ambiente; caso esteja no estado líquido será denominado "óleo".
As ceras são duras à temperatura ambiente e macias quando são aquecidas. As ceras, por hidrólise, liberam "uma" molécula de álcool e ácidos graxos, ambos de cadeia longa.
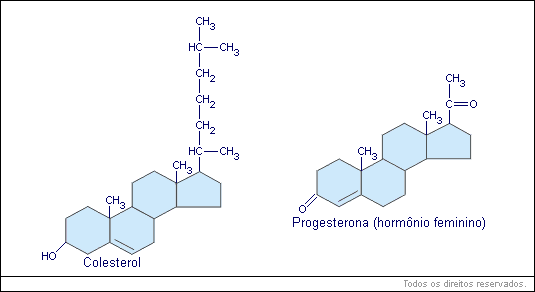
Os esteroides são lipídios de cadeia complexa. Como exemplo pode-se citar o colesterol e alguns hormônios: estrógenos, testosterona.
Funções dos lipídios nos seres vivos
a) são constituintes da membrana plasmática e de todas as membranas internas da célula (fosfolipídios);
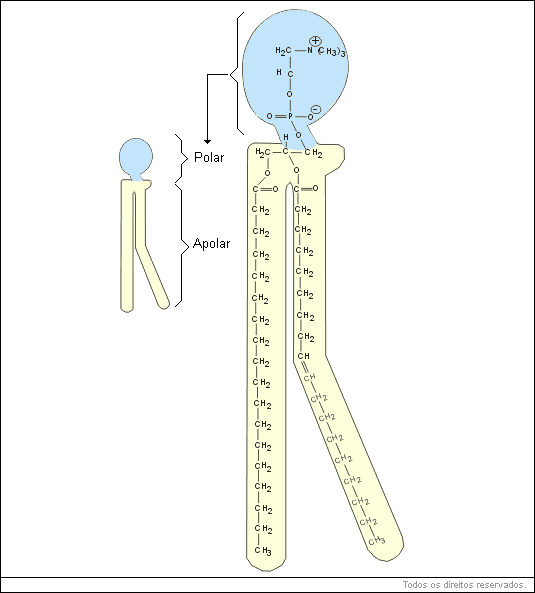
b) fornecem energia quando oxidados pelas células. São normalmente usados como reserva energética;
c) fazem parte da estrutura de algumas vitaminas (A, D, E e K);
d) originam alguns hormônios (andrógenos, progesterona, etc.);
e) ajudam na proteção, pois as ceras são encontradas na pele, nos pelos, nas penas, nas folhas, impedindo a desidratação dessas estruturas, através de um efeito impermeabilizante.
Proteínas
São os principais constituintes estruturais das células. Elas têm três papéis fundamentais:
1º - estruturam a matéria viva (função plástica), formando as fibras dos tecidos;
2º - aceleram as reações químicas celulares (catalisadoras) - neste caso as proteínas são chamadas de enzimas (catalisadores orgânicos);
3º funcionam como elementos de defesa (anticorpos).
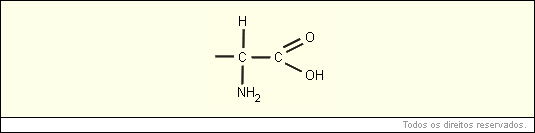
As proteínas são macromoléculas orgânicas formadas pela junção de muitos aminoácidos (AA). Os aminoácidos são as unidades (monômeros) que constituem as proteínas (polímeros). Qualquer aminoácido contém um grupo carboxila e um grupo amina.
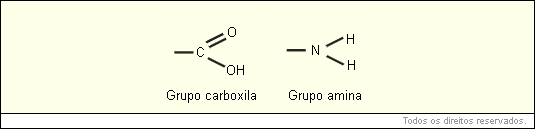
A fórmula geral de um aminoácido está representada abaixo:
A ligação química entre dois AA chama-se ligação peptídica, e acontece sempre entre o C do radical ácido de um AA e o N do radical amina do outro AA.
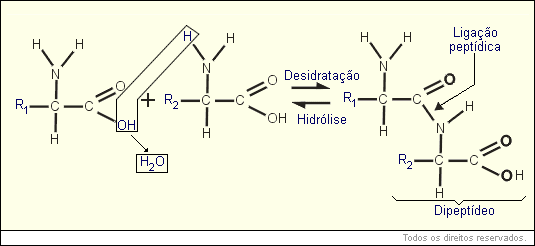
Quando a ligação ocorre entre 2 AA chamamos a molécula formada de dipeptídeo. Quando ocorre com 3 AA chamamos de tripeptídeo. Acima de 4 AA a molécula é chamada de polipeptídeo. As proteínas são sempre polipeptídeos (costumam ter acima de 80 AA).
Existem vinte tipos diferentes de AA que fazem parte das proteínas. Um mesmo AA pode aparecer várias vezes na mesma molécula.
|
Aminoácidos |
Aminoácidos |
|
Histidina (His) |
Alanina (Ala) |
|
Isoleucina (Iso) |
Arginina (Arg) |
|
Leucina (Leu) |
Asparagina (Asn) |
|
Lisina (Lis) |
Ácido aspártico (Asp) |
|
Metionina (Met) |
Cisteína (Cis) |
|
Fenilalanina (Fen) |
Ácido glutâmico (Glu) |
|
Treonina (Tre) |
Glicina (Gli) |
|
Triptofano (Tri) |
Glutamina (Gln) |
|
Valina (Val) |
Prolina (Pro) |
|
Serina (Ser) |
|
|
Tirosina (Tir) |
Parte desses AA são essenciais (precisam ser obtidos da alimentação), a partir dos quais o organismo pode sintetizar todos os demais (AA naturais).
O que diferencia um AA de outro é o radical R.
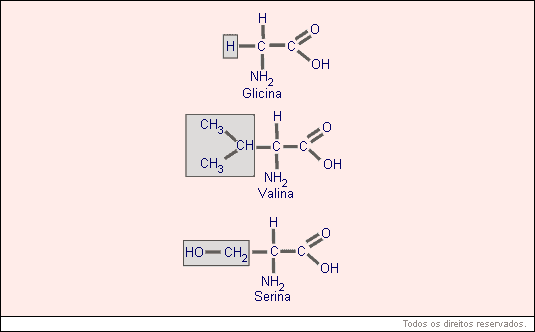
Se o número de aminoácidos, que formam determinada molécula, for superior a 80, convencionalmente, ela será chamada de proteína. Apesar de existirem somente 20 AA, o número de proteínas possível é praticamente infinito.
As proteínas diferem entre si devido:
a) a quantidade de AA na molécula,
b) os tipos de AA,
c) a sequência dos AA na molécula.
Duas proteínas podem ter os mesmos AA nas mesmas quantidades, porém se a sequência dos AA for diferente, as proteínas serão diferentes. Exemplo: imagine que cada letra da palavra AMOR seja um AA. Quantas palavras diferentes podemos escrever com essas letras?
ROMA, MORA, OMAR, RAMO, etc.
A sequência dos AA na cadeia polipeptídica é o que chamamos de estrutura primária da proteína. Se a estrutura primária de uma proteína for mudada, a proteína é mudada. A estrutura primária é importante para a forma espacial da proteína.
O fio proteico (estrutura primária) não fica esticado, mas sim enrolado como um fio de telefone (forma helicoidal), devido à projeção espacial da ligação peptídica. Essa forma é chamada de estrutura secundária.
Em muitas proteínas a própria hélice (estrutura secundária) sofre dobramento sobre si mesma, adquirindo forma globosa chamada de estrutura terciária.
É essa estrutura terciária (espacial = tridimensional) que determina a função biologicamente ativa, fazendo a proteína trabalhar como enzima, anticorpo, etc.
Vários fatores tais como, temperatura, grau de acidez (pH), concentração de sais e outros podem alterar a estrutura espacial de uma proteína, sem alterar a sua estrutura primária. Este fenômeno é chamado de desnaturação.
Uma das funções das proteínas é a função estrutural, pois fazem parte da arquitetura das células e tecidos dos organismos.
|
PROTEÍNAS ESTRUTURAIS |
|
|
PROTEÍNA |
PAPEL BIOLÓGICO |
|
Colágeno |
Proteína presente nos ossos, cartilagens e tendões, e também na pele. Aumenta a resistência desses tecidos à tração. |
|
Queratina |
Recobre a superfície da pele dos vertebrados terrestres. É o mais abundante componente de unhas, garras, corpos, bicos e pelos dos vertebrados. Impermeabilizam as superfícies corpóreas, diminuindo a desidratação. |
|
Actina e miosina |
Principais constituintes do músculo. Responsáveis pela contratilidade do músculo. |
|
Albumina |
Proteína mais abundante do plasma sanguíneo,conferindo-lhe viscosidade, pressão osmótica e função tampão. |
|
Hemoglobina |
Proteína presente nas hemácias. Relacionada ao transporte de gases pelas células vermelhas do sangue. |
Além da função estrutural as proteínas atuam como catalisadoras das reações químicas que ocorrem nas células. São as enzimas. A maior parte das informações contidas no DNA dos organismos, é referente à fabricação de enzimas.
Cada reação que ocorre na célula necessita de uma enzima específica, isto é, uma mesma enzima não catalisa duas reações diferentes. A especificidade das enzimas é explicada pelo modelo da chave (reagente) e fechadura (enzima). A forma espacial da enzima deve ser complementar à forma espacial dos reagentes (substratos). As enzimas não são descartáveis, uma enzima pode ser usada diversas vezes.
|
HOLOENZIMA = |
APOENZIMA + |
COENZIMA+ |
COFATOR |
|
⇓ |
⇓ |
⇓ |
⇓ |
|
(enzima conjugada) |
(proteína) |
(orgânica) |
(inorgânica) |
|
⇓ |
⇓ |
⇓ |
|
|
estrutura 3 ária |
VITAMINA |
sal=íon |
|
|
(atividade biológica) |
A desnaturação de uma enzima implica na sua inatividade, pois perdendo sua forma espacial ela não consegue mais se encaixar ao seu substrato específico.
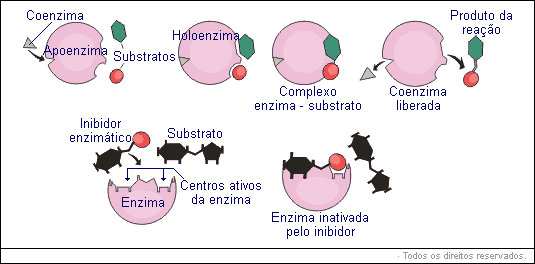
Um inibidor enzimático tem forma semelhante ao substrato (reagente). Encaixando-se na enzima, bloqueia a entrada do substrato, inibindo a reação química.
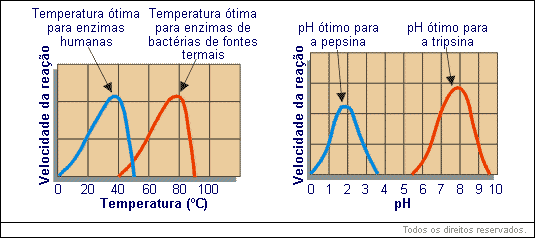
A temperatura é um fator importante na velocidade da atividade enzimática. A velocidade da reação enzimática aumenta com o aumento da temperatura até certo limite, então a velocidade diminui bruscamente. Para cada tipo de enzima existe uma temperatura ótima. Para os seres humanos, a maioria das enzimas tem sua temperatura ótima de funcionamento entre 35 e 40º C.
Sumário
- Glicídios- Lipídios
i. Funções dos lipídios nos seres vivos
- Proteínas
Áreas exclusivas para assinantes





