Estudo dos Gases
- Home
- Estudo Dos Gases
Estudo dos Gases - Transformações gasosas
Gás ideal ou perfeito é um gás hipotético cujas moléculas não apresentam volume próprio (tamanho desprezível) fazendo com que o volume ocupado por ele seja o volume do recipiente que o contém. Gás é um fluído que sofre grandes variações de volume quando submetido a baixas pressões. Isso faz com que tenha duas características importantes, a expansibilidade e a compressibilidade.
Os gases reais adquirem comportamento próximo do de um gás ideal quando está submetido a baixas pressões e a altas temperaturas.
O comportamento de um gás é analisado através de grandezas físicas, a ele associadas, chamadas variáveis de estado.
As variáveis de estado que caracterizam um gás são: volume (V), pressão (p) e temperatura (T).
MOL
Da Química, sabe-se que os átomos e moléculas combinam-se segundo proporções bem definidas, cujas massas são chamadas massa atômica e massa molecular, respectivamente. Experimentalmente, mostra-se que, quando a massa de uma porção de um gás medida em gramas é numericamente igual à massa molecular do mesmo, o número de moléculas dessa porção é igual a 6,02.1023 moléculas. A este número dá-se o nome de número de Avogadro.
Todo "pacote" de partículas, cujo número corresponde ao número de Avogadro, recebe o nome de mol. Por comodidade costuma-se avaliar uma porção de gás através do seu número de mols (n).
![]() , onde m é a massa de uma porção de gás e M é a massa de um mol desse gás.
, onde m é a massa de uma porção de gás e M é a massa de um mol desse gás.
TRANSFORMAÇÕES GASOSAS
Uma transformação gasosa ocorre quando há mudança nas variáveis de estado de um gás.

Há certas transformações que são consideradas especiais ou particulares: a isocórica (V constante), a isobárica (p constante), e a isotérmica (T constante).
A possibilidade de existir tais transformações foi constatada por experiências realizadas.
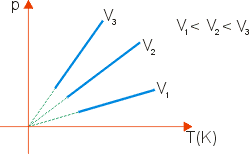
Transformação isocórica (Lei de Charles)
Para um dado número n de mols, tem-se:
![]() , onde T é a temperatura absoluta (em kelvin) do gás e K a constante de proporcionalidade.
, onde T é a temperatura absoluta (em kelvin) do gás e K a constante de proporcionalidade.
Portanto, entre dois estados quaisquer, tem-se que
![]()
Graficamente, tem-se:
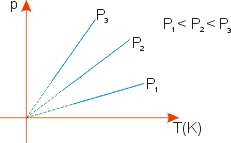
Transformação isobárica (Lei de Gay - Lussac)
Para um dado número n de mols, tem-se:
![]() , onde T é a temperatura absoluta e K a constante de proporcionalidade.
, onde T é a temperatura absoluta e K a constante de proporcionalidade.
Portanto, entre dois estados quaisquer, tem-se que:
![]() .
.
Graficamente, tem-se:
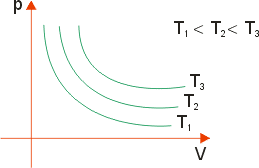
Transformação isotérmica (Lei de Boyle)
Para um dado número n de mols, tem-se:
T const ⇒ p . V = const ou
![]() , onde K é a constante de proporcionalidade.
, onde K é a constante de proporcionalidade.
Portanto, entre dois estados quaisquer, tem-se que:
pi . Vi = pf . Vf
Graficamente, tem-se:
Transformações sucessivas
Para se representar sucessão de transformações gasosas, utiliza-se o diagrama p X V.
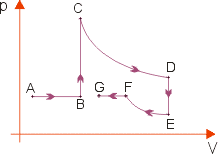
AB: expansão isobárica
BC: isocórica
CD: expansão isotérmica
DE: isocórica
EF: compressão isotérmica
FG: compressão isobárica
LEI GERAL DOS GASES
É uma consequência das leis que regem as três transformações descritas
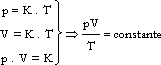
ou ![]() , onde K é uma constante de proporcionalidade que depende da natureza do gás e da sua massa.
, onde K é uma constante de proporcionalidade que depende da natureza do gás e da sua massa.
Entre dois estados quaisquer, tem-se que:
![]()
RELAÇÃO DE CLAPEYRON
É uma relação que estabelece que a constante de proporcionalidade, do quociente ![]() da lei geral dos gases, é diretamente proporcional ao número n de mols de um gás ideal, ou seja:
da lei geral dos gases, é diretamente proporcional ao número n de mols de um gás ideal, ou seja:
![]() , onde R é uma constante de proporcionalidade igual para todos os gases.
, onde R é uma constante de proporcionalidade igual para todos os gases.
Portanto, R não é uma constante característica de um gás. Por esse motivo é chamado de constante universal dos gases.
O valor dessa constante, que depende das unidades utilizadas, pode ser:
![]() ou
ou ![]() no SI.
no SI.
CNTP ou TPN
Um gás está em condições normais de temperatura e pressão (CNTP) quando está submetido a 1 atm (105 N/m2) de pressão e à temperatura de 0° C (273 K).
Sumário
- Mol- Transformações gasosas
i. Transformação isocórica
ii. Transformação isobárica
iii. Transformação isotérmica
iv. Transformações sucessivas
- Lei Geral dos Gases
- Relação de Clapeyron
i. CNTP ou TPN
Áreas exclusivas para assinantes





