Estequiometria
- Home
- Estequiometria
CÁLCULO ESTEQUIOMÉTRICO
LEIS PONDERAIS
LEI DE LAVOISIER (CONSERVAÇÃO DAS MASSAS)
Em uma reação química, a massa que reage é igual à massa produzida.
Isso porque há uma conservação no número de átomos: aí surge o balanceamento das equações químicas.
Nº de átomos dos reagentes = Nº de átomos dos produtos.
|
Na natureza, nada se cria, nada se perde, tudo se transforma. |
A Lei de Lavoisier é a lei da conservação das massas: em uma reação química, a massa permanece constante, ou seja, a massa dos reagentes é igual à massa dos produtos.
Exemplos:
Massas molares: H = 1, S = 32, O = 16.
Calculamos as massas molares das substâncias:
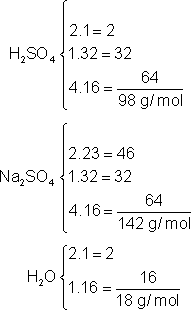
H2SO4: 98g/mol (98 gramas por mol)
NaOH: 40g/mol (40 gramas por mol)
Na2 SO4: 142g/mol (142 gramas por mol)
H2O: 18g/mol (18 gramas por mol)
Na reação:
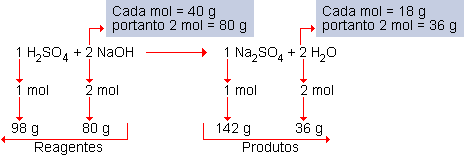
|
Massa dos reagentes |
Massa dos produtos |
|
98 + 80 = 178g |
142 + 36 = 178g |
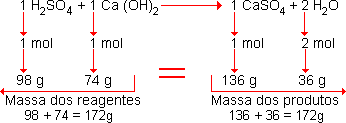
Outro exemplo:
H2SO4: 98/mol
Ca(OH)2: 74g/mol
Ca SO4: 136g/mol
H2O: 18g/mol
Em uma reação química, algumas ligações entre átomos são desfeitas enquanto outras são feitas, formando novas substâncias. Mas os mesmos átomos permanecem em quantidade igual; apenas a fórmula muda. Isto é o significado da Lei de Lavoisier de que na natureza nada se perde, nada se cria, tudo se transforma.
É a conservação do número de átomos numa reação química que garante a conservação da massa.
|
Número de átomos dos reagentes = número de átomos dos produtos. |
Baseado nesse fato, é possível determinar os números que aparecem à esquerda da fórmula numa reação. Estes números são chamados de coeficientes estequiométricos. Para obtê-los, basta igualar o número de átomos que reagiram com o número de átomos produzidos.
É a conservação do número de átomos numa reação química que garante a conservação da massa. Número de átomos dos reagentes = número de átomos dos produtos. Baseado nesse fato, é possível determinar os números que aparecem à esquerda da fórmula numa reação. Estes números são chamados de coeficientes estequiométricos. Para obtê-los, basta igualar o número de átomos que reagiram com o número de átomos produzidos.
Há vários métodos para determinar os coeficientes do balanceamento estequiométricos de uma reação. Um dos métodos é o método das tentativas.
Outro dado importante para o balanceamento de equações químicas:
O coeficiente do balanceamento multiplica todos os índices da fórmula. Veja nos exemplos abaixo:
Exemplos:
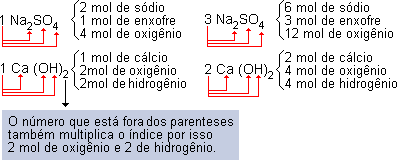
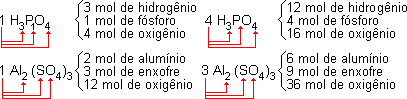
Toda equação química deve estar balanceada, ou seja, o número de átomos do reagente é sempre igual ao número de átomos do produto.
|
Para representar uma reação química corretamente, é necessário que sejam observados dois aspectos:
|
LEI DE PROUST
Há uma proporção constante entre as massas de reagentes e produtos numa reação.
Isto significa que qualquer alteração que se faça em qualquer substância participante da reação, temos que promover a mesma alteração proporcional em todas as outras substâncias desta reação.
Exemplo 1
|
Cálcio + Oxigênio → Óxido de cálcio |
|||||
|
Experimento 1 |
10 g |
|
4g |
|
14g |
|
x2 ↓ |
|
x2 ↓ |
|
x2 ↓ |
|
|
Experimento 2 |
20 g |
|
8 g |
|
28 g |
|
x2 ↓ |
|
x2 ↓ |
|
x2 ↓ |
|
|
Experimento 3 |
40 g |
|
16 g |
|
56 g |
Numa reação, os coeficientes do balanceamento representam o número de mol de cada participante de uma reação.
Vamos recordar:
|
massa molar = massa de 1 mol = (massa da fórmula) |
Exemplo 2
Da tabela periódica temos as massas atômicas: H = 1, O = 16, N = 14, C = 12
Determinação das massas molares:
|
H2O
(água) |
 |
H → 2 . 1 | = | 2 |
N2
(nitrogênio) |
 |
N → 2 . 14 = 28 g/mol | |
O → 1 . 16 |
= |
+ 16 18 g/mol |
||||||
| 1 mol N2 = 28 g | ||||||||
|
1 mol H2O = 18 g |
||||||||
Exemplo 3
A massa de água produzida e a massa de oxigênio necessária para reagir com 4 kg (4000 g) de hidrogênio.
Na reação:
|
2H2 |
+ |
O2 |
→
|
2H2O |
|
|
Receita |
4g |
|
32 g |
|
36 g |
|
↓
x1000 |
|
↓
x1000 |
|
↓
x1000 |
|
|
4000 g |
|
x = ? |
|
y = ? |
|
|
|
|
x = 32000 g |
|
y = 36000 g |
|
A massa de hidrogênio foi multiplicada por 1000. Logo as massas de oxigênio e água também são multiplicadas por 1000. |
4000 (4 kg) de hidrogênio necessitam de 32 000 g (32 kg) de oxigênio para produzir 3 600 g (36 kg) de água.
Sumário
- Leis Ponderaisi. Lei de Lavoisier
ii. Lei de Proust
Áreas exclusivas para assinantes