Distribuição Eletrônica
- Home
- Distribuição Eletrônica
Distribuição Eletrônica
Em um átomo, os elétrons se distribuem de forma organizada em torno do núcleo. Essa organização é chamada distribuição eletrônica.
Níveis ou Camadas de Energia
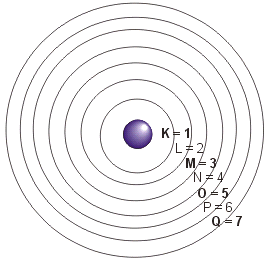
Num átomo, os elétrons movimentam-se em trajetórias circulares denominadas camadas ou níveis de energia, e cada um desses níveis apresenta um certo valor energético.
Os níveis de energia dos elétrons são conhecidos como camadas eletrônicas. Os átomos dos elementos químicos conhecidos apresentam elétrons até o sétimo nível de energia.
| K | L | M | N | O | P | Q |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
Em cada uma destas camadas, existe um número máximo de elétrons possível.
|
Camadas ou níveis de energia |
K |
L |
M |
N |
O |
P |
Q |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
|
Número máximo de elétrons possíveis |
2 |
8 |
18 |
32 |
32 |
18 |
2 |
Subníveis de Energia
Em 1916, o físico alemão Sommerfeld, percebeu que os níveis de energia apresentavam subníveis.
Os subníveis de energia são identificados pelas letras minúsculas: s, p, d, f, g, h, i, ....
A partir dos modelos de Rutherford-Bohr e Sommerfeld, Linus Pauling propôs a distribuição dos elétrons na eletrosfera de um átomo, denominada de configuração ou distribuição eletrônica.
Veja abaixo:
|
Níveis de energia |
K |
L |
M |
N |
O |
P |
Q |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
|
Subníveis de energia |
s |
p |
d |
f |
g |
h |
i |
|
K |
1s |
|
|
|
|
|
|
1ª Camada (K) |
1 subnível (s) |
|
L |
2s |
2p |
|
|
|
|
|
2ª Camada (L) |
2 subníveis (s e p) |
|
M |
3s |
3p |
3d |
|
|
|
|
3ª Camada (M) |
3 subníveis (s, p, d) |
|
N |
4s |
4p |
4d |
4f |
|
|
|
4ª Camada (N) |
4 subníveis (s, p, d, f) |
|
O |
5s |
5p |
5d |
5f |
5g |
|
|
5ª Camada (O) |
5 subníveis (s, p, d, f, g) |
|
P |
6s |
6p |
6d |
6f |
6g |
6h |
|
6ª Camada (P) |
6 subníveis (s, p, d, f, g, h) |
|
Q |
7s |
7p |
7d |
7f |
7g |
7h |
7i |
7ª Camada (Q) |
7 subníveis (s, p, d, f, g, h , i ) |
O quadro abaixo mostra o número máximo de elétrons possível em cada subnível:
|
subnível |
s |
p |
d |
f |
|
|
nº máximo de elétrons |
2 |
6 |
10 |
14 |

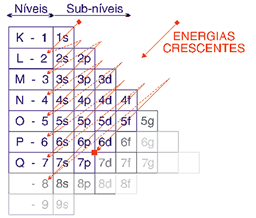
Diagrama de Energias - Diagrama de Pauling
Linus Pauling chegou a uma distribuição eletrônica representada graficamente pelo esquema conhecido como Diagrama de Pauling.
|
DIAGRAMA DE PAULING Em um átomo no estado fundamental (elétrons não excitados por luz, calor, etc.), os elétrons estão distribuídos em ordem crescente de energia, seguindo as diagonais do diagrama:
|
Diagrama de energias dá a ocorrência de cada subnível nos níveis, bem como a ordem de energias crescentes
- Subnível mais energético é o último da distribuição de acordo com o diagrama de energia.
- Camada de valência é a camada (nível) mais externa.
Exemplos: Distribuição eletrônica
(Subníveis) 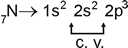
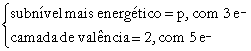
(Níveis ou Camadas) 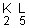
(Subníveis) 21Sc  1s2 2s2 2p6 3s2 3p6 4s2 3d1
1s2 2s2 2p6 3s2 3p6 4s2 3d1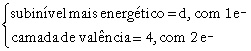
(Níveis) 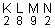
Distribuição Eletrônica
|
Regra de distribuição eletrônica Os elétrons distribuem-se na eletrosfera em ordem crescente de energia; por isso, o subnível mais energético é sempre o último da distribuição eletrônica, mesmo quando é interno. |
Camada (nível) de Valência
Nível de valência é a camada eletrônica mais externa do átomo.
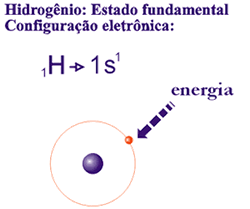
Estado Fundamental e Estado Excitado
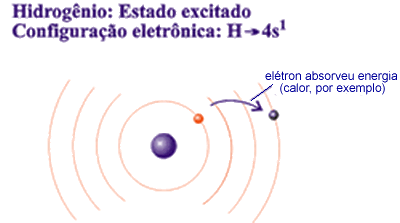
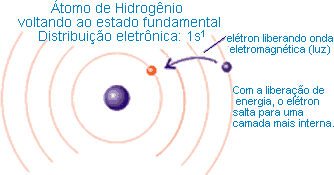
Quando a distribuição eletrônica de um átomo segue rigorosamente o diagrama de Pauling, dizemos que ele está no estado fundamental. Mas, quando um átomo recebe energia, seus elétrons absorvem energia, saltando para níveis mais externos, mais energéticos; nesse caso, o átomo fica momentaneamente com mais energia que em seu estado fundamental. Dizemos que passa do estado fundamental para o estado excitado. A volta desse elétron ao nível de origem ocorre com liberação de energia na forma de ondas eletromagnéticas (energia luminosa e térmica, por exemplo).
Quanto mais externo o nível em que se encontra o elétron, maior sua energia.
Por exemplo
11Na → 1s2 2s2 2p6 3s1 - estado fundamental.
11Na → 1s2 2s2 2p6 6s1 - estado excitado
O elétron 6s1 absorveu energia e saltou da camada 3(M) para a camada 6(P); portanto está no estado excitado. Ao voltar para a camada M, o elétron libera energia na forma de luz que, no caso do sódio, é amarela.
É esse fenômeno que explica as cores nos testes de chama, nos fogos de artifício e nos luminosos de propaganda.
Distribuição Eletrônica de Íons
Distribuição Eletrônica de Cátions
Cátion é um íon positivo formado quando um átomo neutro perde elétrons, que saem da camada de valência.
Para fazer a distribuição eletrônica de um cátion siga os passos:
- Distribuir os elétrons do átomo neutro;
- Identificar a camada de valência e dela retirar o número de elétrons segundo a carga elétrica do íon.
Exemplo
distribuição eletrônica do cátion Co2+
Distribuição eletrônica do átomo neutro do Co:
27 Co → 1s2 2s2 2p6 3s2 3p6 4s2 3d 7
camada de valência (de onde saem os elétrons): 4s2
Distribuição eletrônica do cátion bivalente do cobalto Co2+
27 Co2+ → 1s2 2s2 2p6 3s2 3p6 3d7
Camadas: K= 2 L = 8 M = 15
Distribuição Eletrônica de Ânions
Ânion é um íon negativo formado quando um átomo neutro adquire elétrons. Os elétrons ganhos entram na camada de valência , no subnível mais energético.
Para fazer a distribuição eletrônica de um ânion, procede-se como no caso dos cátions: faz-se, inicialmente, a distribuição dos elétrons do átomo neutro; em seguida, identifica-se a camada de valência e acrescenta-se os elétrons adquiridos no subnível mais energético.
Exemplo
distribuição eletrônica do ânion O2-
Distribuição eletrônica do átomo neutro de O:
8O -> 1s2 2s2 2p4
camada de valência (onde entram os elétrons): 2p
Distribuição eletrônica do ânion bivalente do Oxigênio O2-
O2- -> 1s2 2s2 2p6
Camadas: K= 2 L = 8
Orbitais e Spin
Em 1926, Heisenberg propôs o "princípio da incerteza" que, aplicado ao átomo, mostra ser impossível determinar a trajetória do elétron em torno do núcleo. Para contornar o problema, Schrödinger e, depois, Born desenvolveram o conceito de orbital como uma região do espaço onde é muito provável (mas não absolutamente certo) encontrar o elétron.
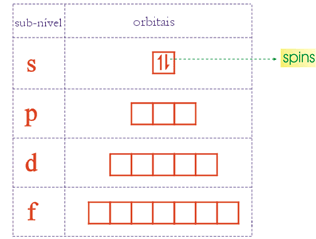
O Princípio de Pauli: "dois elétrons só ocupam o mesmo orbital se possuírem spins opostos".
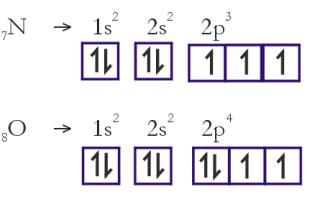
REGRA DE HUND: A distribuição dos elétrons nos orbitais de um mesmo subnível deve ser feita de modo que se tenha o maior número possível de elétrons desemparelhados.
Exemplos
Sumário
- Níveis ou Camadas de Energia
- Subníveis de Energia
- Diagrama de Energias - Diagrama de Pauling
- Distribuição Eletrônica
- Camada de Valência
- Estado Fundamental e Estado Excitado
- Distribuição Eletrônica de Íons
i. Distribuição Eletrônica de Cátions
ii. Distribuição Eletrônica de Ânions
- Orbitais e Spin
Áreas exclusivas para assinantes