Condutividade Elétrica
- Home
- Condutividade Elétrica
Moléculas e íons são partículas tão pequenas que não conseguimos enxergá-las. Conseguimos ver a matéria porque é uma agrupação de uma quantidade enorme de moléculas ou íons.
Fazemos a seguinte pergunta: quando dissolvemos uma substância, por que ela desaparece?
Dissolver é separar. Portanto, quando um composto é dissolvido, é separada molécula a molécula, íon a íon. Em outras palavras, a separação é feita em partículas tão pequenas que não mais enxergamos a matéria: por esse motivo, temos a impressão de que ela desapareceu.
TEORIA DE ARRHENIUS
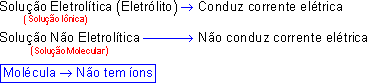
Uma solução conduz corrente elétrica quando nela há íons livres (solução iônica).
COMPOSTO MOLECULAR
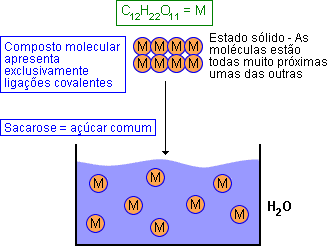
Considere um composto molecular no estado sólido: a sacarose (C12 H22 O11), por exemplo:
 |
|
Quando dissolvida, molécula a molécula, não mais pode ser enxergada a olho nu.
Na molécula, não há ganho ou perda de elétrons. Essa solução é eletricamente neutra: não tem íons livres; portanto, não conduz corrente elétrica.
Os compostos moleculares não conduzem corrente elétrica no estado sólido, nem quando dissolvidos em água. Soluções ácidas são a exceção.
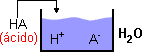 |
Ácido Importantes
|
Os ácidos são compostos moleculares que em solução aquosa liberam H+.
Os ácidos formam soluções iônicas, ou seja, geram íons livres, o que garante a condutividade de corrente elétrica.
COMPOSTO IÔNICO
Todo composto iônico é sólido nas condições ambientais.
Vamos tomar como exemplo o NaCl (sal de cozinha):
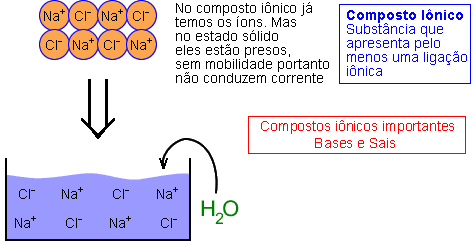
Ao dissolver o composto iônico em água, os íons são separados; ou seja, são gerados íons livres na solução (solução iônica) e, portanto, há condutividade de corrente elétrica.
Uma outra maneira de separar os íons é aquecê-los até que passem para o estado líquido (quando alcançam o ponto de fusão).
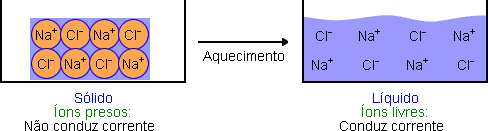
|
Fundir = aquecer até passar ao estado líquido |
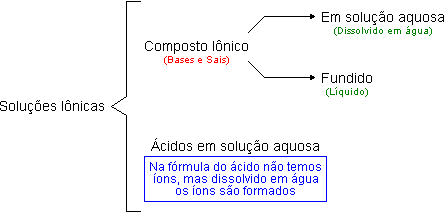
RESUMINDO
![]()
![]()
COMENTÁRIOS IMPORTANTES:
Se a solução conduz corrente elétrica é porque tem íons livres.
As possibilidades são:
- 1. um ácido dissolvido em água (solução aquosa)
- 2. um composto iônico (bases e sais) dissolvido em água ou fundidos.
Testar a condutividade elétrica de uma solução é simples.
Observe a figura:
Uma experiência científica: Pegue três copos. Num deles dissolva em água um pouco de açúcar; no segundo copo, dissolva em água um pouco de sal; no terceiro copo, coloque um pouco de vinagre.
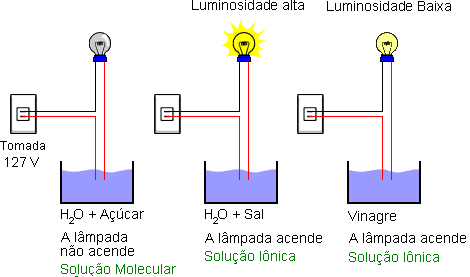
Ao fazer esse teste, você observará que a luminosidade da lâmpada na solução de sal é muito mais intensa do que a que está na solução de vinagre. Isto porque na solução salina, a quantidade de íons é maior. Portanto, há maior condutividade de corrente elétrica.
Se a solução apresenta íons livres, conduz corrente. Quanto maior a quantidade de íons, maior a condutividade elétrica e maior a luminosidade da lâmpada.
OUTRO COMENTÁRIO IMPORTANTE:
Se colocarmos água pura, a lâmpada não acende. Mas com uma aparelhagem mais específica, constata-se que a água pura conduz corrente.
Então, porque a lâmpada não acende?
Porque a quantidade de íons na água pura é muito pequena. Por isso, a condutividade de corrente elétrica é muito baixa, insuficiente para acender a lâmpada.
O correto é dizer: A água é má condutora de corrente elétrica.
Sumário
- Teoria de Arrhenius- Composto Molecular
- Composto Iônico
Áreas exclusivas para assinantes





