Classificação dos elementos
- Home
- Classificação Dos Elementos
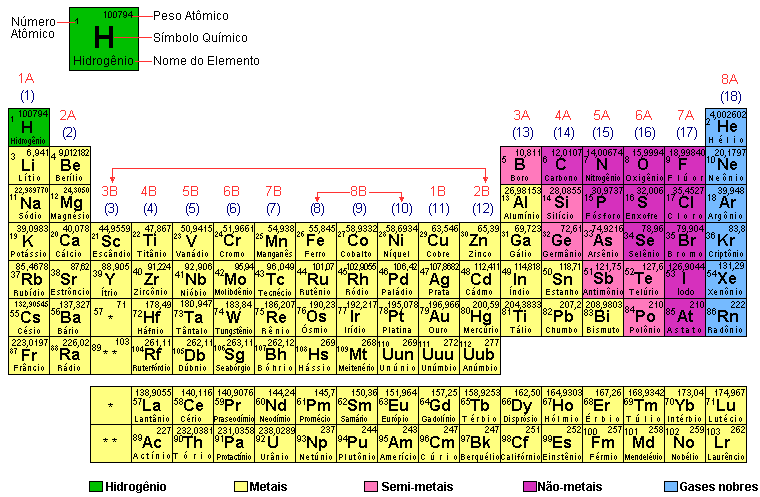
Os elementos químicos estão dispostos na tabela periódica em ordem crescente de número atômico através das horizontais.
Desta maneira é fácil localizar um elemento, e agora vamos mostrar como podemos identificar várias propriedades destes elementos.
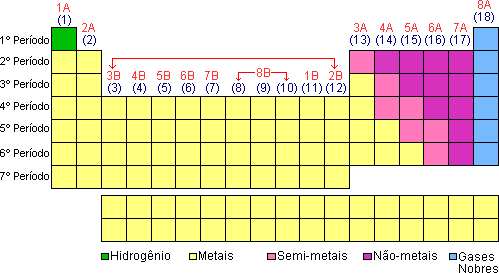
METAIS, NÃO METAIS GASES NOBRES E HIDROGÊNIO
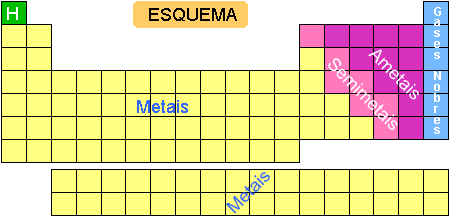
Na tabela periódica temos várias divisões, a primeira que vamos estudar, é a que fica mais evidente, que é esta separação pelas cores.
Os elementos conhecidos na atualidade podem ser divididos nas classes citadas.
De forma geral temos as seguintes propriedades:
Metais: Possuem brilho característico, boa condutibilidade térmica e elétrica e facilidade para formar cátions.
Não metais ou ametais: Sem brilho metálico, maus condutores térmicos e elétricos e facilidade para formar ânions.
O estado físico completamente variável, nas condições ambientes temos:
- Sólidos – C, P, S, Se, I, At
- Líquido – Br
- Gasoso – F, O, N, Cl
Semimetais (Metaloides): Apresentam propriedades intermediárias às dos metais e não metais. São sólidos nas condições ambientes e conduzem razoavelmente o calor e eletricidade.
Gases Nobres: Possuem grande dificuldade em realizar ligações químicas. São elementos que apresentam 8 elétrons na camada de valência com exceção do He.
Hidrogênio: Tem características distintas das classes anteriores.
Segundo esta classificação temos:
PERÍODO
É a linha horizontal presente na tabela periódica. Todos os elementos de um mesmo período apresentam o mesmo número de camadas. O número total de camadas de átomo é identificado pela camada de valência.
Exemplos
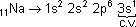
 camada de valência
camada de valência  nº 3
nº 3  3º período (o Sódio está na terceira horizontal da tabela).
3º período (o Sódio está na terceira horizontal da tabela).
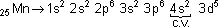
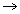 camada de valência
camada de valência 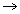 nº 4
nº 4 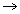 4º período (o Manganês está na quarta horizontal da tabela).
4º período (o Manganês está na quarta horizontal da tabela).
FAMÍLIA OU GRUPOS
São as colunas verticais presentes na tabela, elementos que fazem parte da mesma família apresentam propriedades semelhantes, com algumas poucas exceções.
Na tabela periódica temos as famílias A (elementos representativos) e família B (elementos de transição).
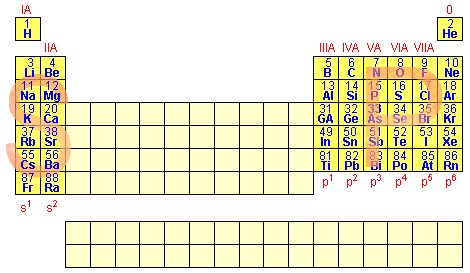
ELEMENTOS REPRESENTATIVOS (Família A)
São elementos que apresentam o subnível s ou p como mais energético.
|
Atualmente a IUPAC (União Internacional de Química Pura e Aplicada) numerou as famílias de 1 a 18 (como mostra a tabela) eliminando as letras. |
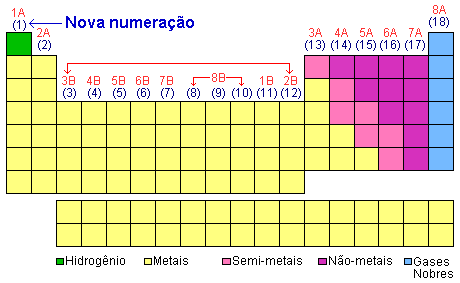
O número de elétrons na camada de valência determina o número da família (A), 1 elétron na camada de valência, família 1A, 2 elétrons na camada de valência, família 2A e assim sucessivamente.
Exemplos
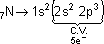 |
Subníveis mais energético p → família A |
|
5e- na camada de valência → família 5A |
FAMÍLIAS IMPORTANTES
Os grupos mais importantes são:
1A – Metais Alcalinos
|
Note que o hidrogênio faz parte da família 1A mas não é metal, por isso não aparece neste caso. |
2A – Metais Alcalinos Terrosos
6A – Calcogênios (Chalcogênios)
7A – Halogênios
O – Gases Nobres
Localizar um elemento na tabela periódica, é determinar a família e o período que ele faz parte.
Exemplo
35Br → 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5
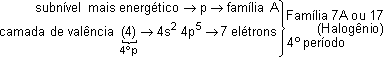
PROPRIEDADES PERIÓDICAS
São aquelas que crescem e decrescem com o aumento do número atômico, para perceber esta periodicidade, discutimos a propriedade na família e no período.
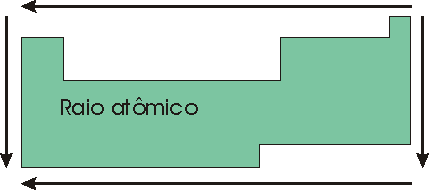
RAIO ATÔMICO (TAMANHO DO ÁTOMO)
O fator determinante no tamanho do átomo é o número de camadas.
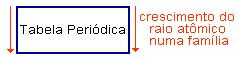
Na família:
|
1A |
|
|
1º Período → 1H → 1 camada |
|
|
2º Período → 3Li → 2 camadas |
|
|
3º Período → 11Na → 3 camadas |
Observe que descendo uma família o número atômico aumenta, aumentando o número de camadas e, portanto, o raio atômico.
No período:
Num período todos apresentam o mesmo número de camadas, nestes casos temos que levar em conta o número de prótons.
Quanto maior o número de prótons no núcleo, maior a atração pelos elétrons (nas camadas), fazendo se aproximarem mais do núcleo, diminuindo assim o tamanho do átomo.
Para um mesmo período, o elemento de maior raio é o que apresenta menor número de prótons (Z), portanto o que está mais à esquerda.
Juntando duas conclusões:
ENERGIA OU POTENCIAL DE IONIZAÇÃO
É a energia absorvida, necessária, para afastar completamente 1 elétron de um átomo no estado gasoso, (é a energia para formar cátions)
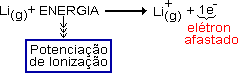
Quanto mais afastado do núcleo estiver o elétron mais fácil será retirado do átomo, logo menor energia gasta, ou seja, menor energia de ionização.
Portanto as maiores energias de ionização são para os átomos de menor tamanho (raio atômico).

Outra análise importante:
- Os metais para alcançarem a estabilidade perdem elétrons, ou seja, menor energia de ionização.
- Os não metais para ficarem estáveis ganham elétrons, portanto para arrancar elétrons destes átomos é mais difícil, ou seja, energia de ionização mais alta.
- Os gases nobres como estão naturalmente estáveis é muito difícil arrancar elétrons, ou seja, apresentam as mais altas energias de ionização.
AFINIDADE ELETRÔNICA
É a energia liberada quando um elétron é adicionado a um átomo gasoso no estado fundamental (é a energia para formar ânion).
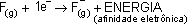
Um átomo para receber o elétron, tem que atrai-lo, esta força de atração (eletronegatividade) é exercida pelos prótons (núcleo) portanto quanto menor for o raio atômico maior será a força de atração e consequentemente maior será a afinidade eletrônica (energia liberada).
Portanto, as maiores afinidades eletrônicas são para os elementos de menor raio.
Os átomos de maiores afinidades eletrônicas são os não metais que para alcançarem a estabilidade precisam ganhar elétrons.
Já os gases nobres (naturalmente estáveis) apresentam afinidade eletrônica zero, por isso são excluídos, observe o esquema abaixo.
ELETRONEGATIVIDADE
É a força relativa para a atração de elétrons.
Os átomos mais eletronegativos são os que apresentam maiores afinidades eletrônicas.

ELETROPOSITIVIDADE (Caráter Metálico)
Mede a capacidade de um átomo perder elétrons (formar cátions).
Os átomos que apresentam as maiores eletropositividades são os metais (formam cátions) ou seja os de menor energia de ionização.
Portanto a eletropositividade será tanto maior quanto maior for o raio atômico.

DENSIDADE
É a relação entre a massa e o volume
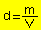
Fazendo esta relação, determina-se que os elementos mais densos estão na parte inferior e central da Tabela Periódica.
Os elementos de maiores densidades são Ósmio, Irídio e Platina.
A variação desta propriedade na tabela periódica fica assim representada:

Sumário
- Metais, não metais gases nobres e hidrogênio- Período
- Família ou Grupos
- Elementos Representativos (Família A)
- Famílias Importantes
- Propriedades Periódicas
- Raio Atômico
- Energia ou Potencial de Ionização
- Afinidade Eletrônica
- Eletronegatividade
- Eletropositividade
- Densidade
Áreas exclusivas para assinantes