Calorimetria
- Home
- Calorimetria
CALORIMETRIA
CALOR (Q)
Quando dois corpos, em temperaturas diferentes, são postos em contato, observa-se que a temperatura do corpo mais quente diminui, enquanto que a temperatura do corpo mais frio aumenta. Essas variações de temperatura cessam quando as temperaturas de ambos se igualam (equilíbrio térmico).
Portanto, durante esse processo, o nível energético (grau de agitação molecular) do corpo mais quente diminui, enquanto que o do corpo mais frio aumenta. Como a energia térmica de um corpo depende, além da sua massa e da substância que a constitui, da sua temperatura, conclui-se que as variações de temperatura estão associadas às variações de energia térmica.
Concluindo, a diferença de temperatura entre dois corpos provoca uma transferência espontânea de energia térmica do corpo de maior temperatura para o corpo de menor temperatura. Essa quantidade de energia térmica que se transferiu é chamada de calor.
![]()
Calor é energia térmica em trânsito entre corpos a diferentes temperaturas.
Unidades
No S.I. o calor é medido em J (joule). Usualmente utiliza-se a cal (caloria), tal que:
|
1 cal = 4,186 J |
Sinal do Calor
O calor (quantidade de energia térmica) é positivo (Q > 0) quando um corpo recebe energia térmica e negativo (Q < 0) quando perde.
Calor "perdido": Q < 0
Calor "recebido": Q > 0
Formas de Calor
A quantidade de energia térmica recebida ou perdida por um corpo pode provocar uma variação de temperatura ou uma mudança de fase (estado de agregação molecular).
Se ocorrer variação de temperatura, o calor responsável por isso chamar-se-á calor sensível. Se ocorrer mudança de fase, o calor chamar-se-á calor latente.
CÁLCULO DO CALOR
Calor Sensível
Verifica-se experimentalmente que o valor do calor sensível depende da substância utilizada, e da variação de temperatura sofrida por ela. Esse valor é obtido pela relação abaixo
Q = m . c .ΔQ,
onde c é um coeficiente de proporcionalidade chamado calor específico sensível de uma substância.
Esse coeficiente depende da natureza da substância, da sua temperatura e da fase em que se encontra.
A influência da temperatura não será considerada, pois utiliza-se um valor médio para o calor específico sensível.
Observações:
1ª - A unidade de c no S.I. é dada por J/kg .K, mas usualmente utiliza-se cal/goC, pois:
C = ![]()
2ª - O produto (m . c) é chamado capacidade térmica C de um corpo, ou seja:
![]()
Desta relação conclui-se que a capacidade térmica é medida em J/K no S.I. e em cal/ ºC no sistema usual.
3ª - Das relações anteriormente definidas, concluiu-se que, tanto a capacidade térmica como o calor específico sensível, são grandezas positivas, pois:
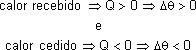 .
.
Calor Latente
Verifica-se experimentalmente que o valor do calor latente depende apenas da substância utilizada e é obtido pela relação a seguir:
Q = m. L,
onde L é um coeficiente de proporcionalidade chamado calor específico latente de uma substância.
Esse coeficiente depende da natureza da substância e da fase em que a mesma se encontra.
Observações
1ª - A unidade de L é dada no S.I. por J/kg, mas usualmente utiliza-se cal/g, pois:
![]()
2ª - Desta última relação conclui-se que o valor do calor específico latente pode ser positivo ou negativo, pois:
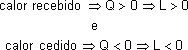 .
.
Durante a mudança de fase de uma substância pura, submetida à uma pressão constante, a temperatura não varia. Por esse motivo, o calor latente não depende da temperatura.
MUDANÇA DE FASE
A matéria pode apresentar-se em três fases ou estados de agregação molecular: sólido, líquido e vapor.
Os sólidos têm forma própria, volume bem definido e suas moléculas têm pouca liberdade pois as forças de coesão entre elas são muito intensas.
Os líquidos não têm forma própria, mas têm volume definido. Suas moléculas possuem liberdade maior do que nos sólidos, pois as forças de coesão são menores.
Os vapores não possuem nem forma nem volume definidos. Devido a fracas forças de coesão suas moléculas têm grande liberdade.
Processos de Mudança de Fase
- Fusão: passagem de sólido para líquido;
- Solidificação: passagem de líquido para sólido;
- Vaporização: passagem de líquido para vapor;
- Condensação: passagem de vapor para líquido
- Sublimação: passagem de sólido para vapor ou vapor para sólido, também conhecido como cristalização.
A mudança de fase pode ser uma transformação endotérmica (Q > 0) ou exotérmica (Q < 0).
A fusão, a vaporização e a sublimação são transformações endotérmicas. A solidificação, a condensação e a cristalização são transformações exotérmicas.
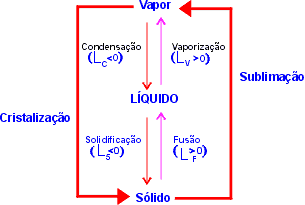
Observação
| Lf | = | Ls | e | Lv | = | Lc |
Curvas de Mudança de Fase
São curvas obtidas, construindo, num diagrama cartesiano, o gráfico da temperatura de um corpo em função do calor trocado por ele.
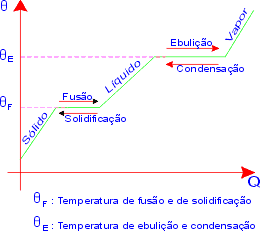
Este gráfico será chamado de curva de aquecimento, se o corpo estiver recebendo energia térmica, ou curva de resfriamento, se o corpo estiver cedendo energia térmica.
POTÊNCIA TÉRMICA
A rapidez com que uma fonte fornece ou retira uma certa quantidade de energia térmica ( calor ) de um corpo é determinada por uma grandeza chamada potência térmica, ou seja:
![]()
a unidade da potência térmica é o W (watt), onde
![]()
é usual adotar-se cal/s ou cal/min como unidade de potência térmica.
TROCAS DE CALOR
Quando corpos, que estão a temperaturas diferentes, são colocados em contato, ocorrem trocas de calor entre eles, que cessam ao ser atingido o equilíbrio térmico.
Para que não haja influência do meio externo nas trocas de calor, é necessário colocá-los em um recipiente isolante térmico chamado calorímetro.
Através do balanço energético, conclui-se que, em módulo, a somatória dos calores cedidos é igual à somatória dos calores recebidos.
![]()
Se os sinais são levados em conta, tem-se:
![]()
ou
Q1 + Q2 + Q3 + ... + Qn = 0
COMPLEMENTOS
Equivalente em Água
Chama-se equivalente em água de um sistema a massa de água cuja capacidade térmica é igual à do sistema considerado.
Calorímetro Ideal
É o calorímetro que é isolante térmico (adiabático) e possui capacidade térmica nula (não participa das trocas de calor).
Tipos de Vaporização
Conforme a maneira de se processar, a vaporização pode ser classificada como evaporação, ebulição ou calefação.
Na evaporação, a mudança de fase ocorre apenas na superfície do líquido, mediante um processo lento, podendo ocorrer a qualquer temperatura.
Na ebulição, a mudança de fase ocorre numa temperatura fixa, para uma dada pressão chamada de temperatura de ebulição. Esse processo ocorre em todo o líquido.
Já na calefação, a mudança de fase ocorre após um aquecimento muito brusco como, por exemplo, uma porção de água que cai numa panela vazia e muito quente.
Sumário
- Calor (Q)i. Unidades
ii. Sinal do Calor
iii. Formas de Calor
- Cálculo do Calor
i. Calor Sensível
ii. Calor Latente
- Mudança de fase
i. Processos de Mudança de Fase
ii. Curvas de Mudança de Fase
- Potência térmica
- Trocas de calor
- Complementos
i. Equivalente em Água
ii. Calorímetro Ideal
iii. Tipos de Vaporização
Áreas exclusivas para assinantes





