Bioquímica - Aminoácidos e Proteínas
- Home
- Bioquímica Aminoácidos E Proteínas
Bioquímica: as proteínas e os aminoácidos
As proteínas são os principais constituintes estruturais das células: são vitais e estão presentes em todas as células vivas. Elas formam as fibras dos tecidos, aceleram as reações químicas celulares (enzimas) e funcionam como elementos de defesa (anticorpos) do corpo. As proteínas estão presentes em: pele, cabelo, cartilagem, músculos, tendões, hormônios, hemoglobina, mioglobina, etc.
As proteínas têm papel fundamental na dieta de animais. Os seres humanos podem ficar muito doentes se não ingerirem proteína em quantidade suficiente. A deficiência proteica – causada pela escassez de proteínas e, portanto, de aminoácidos essenciais – causa lesões físicas e mentais.
Os Aminoácidos
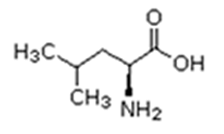
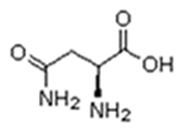
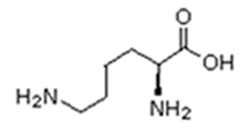
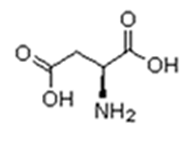
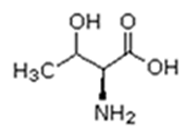
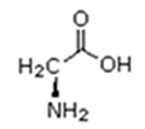
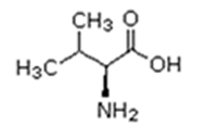
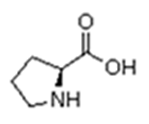
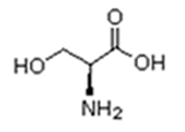
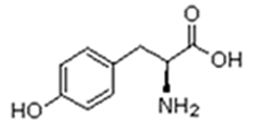
As proteínas são macromoléculas orgânicas formadas pela junção de muitos aminoácidos. Os aminoácidos são os monômeros que constituem as proteínas (polímeros). Qualquer aminoácido contém um grupo carboxila (-COOH), que é ácido, e um grupo amina (-NH2), que é básico.
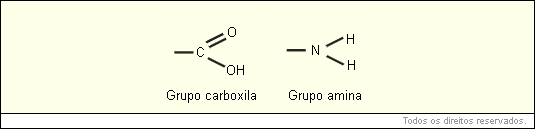
A fórmula geral de um aminoácido está representada abaixo:
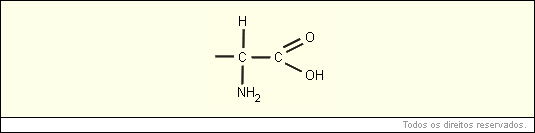
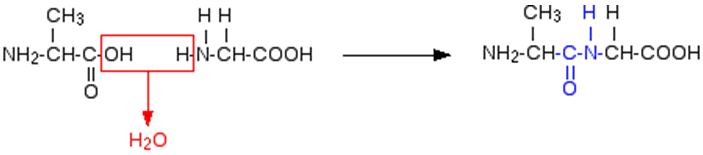
A ligação química entre dois aminoácidos chama-se ligação peptídica, e acontece sempre entre o C do radical ácido de um aminoácido e o N do radical amina do outro aminoácido.
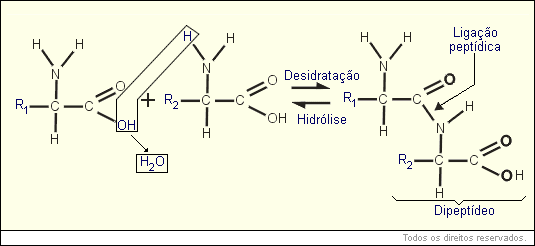
Quando a ligação ocorre entre dois aminoácidos, chamamos a molécula formada de dipeptídeo. Quando ocorre com três aminoácidos, chamamos de tripeptídeo. Acima de quatro aminoácidos, a molécula é chamada de polipeptídeo. As proteínas são sempre polipeptídeos (costumam ter acima de 80 aminoácidos).
Exemplo
Glicina e alanina podem se ligar por meio da eliminação da molécula de água para produzir um dipeptídeo. Essa ligação pode ser feita de duas maneiras diferentes, resultando, portanto, em dois dipeptídeos diferentes.
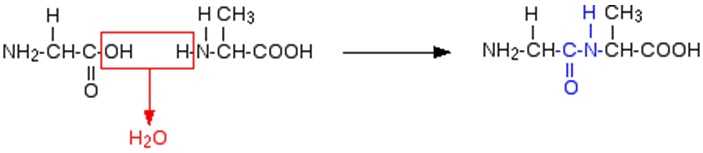
ou
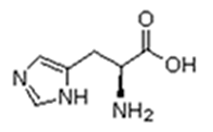
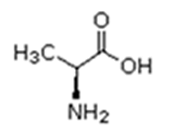
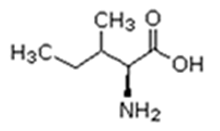
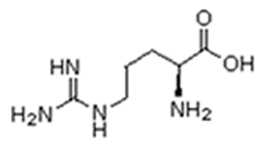
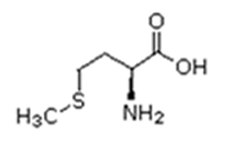
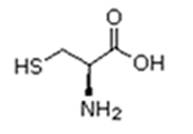
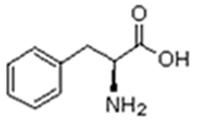
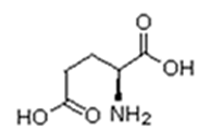
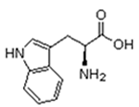
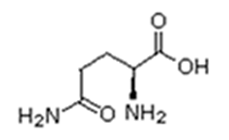
Existem vinte tipos diferentes de aminoácidos que fazem parte das proteínas. Estes são denominados aminoácidos naturais. Um mesmo aminoácido pode aparecer várias vezes na mesma molécula.
Parte desses aminoácidos são essenciais (precisam ser obtidos da alimentação), a partir dos quais o organismo pode sintetizar todos os demais (aminoácidos naturais).
|
Aminoácidos |
Aminoácidos |
||
|
Nome |
Fórmula |
Nome |
Fórmula |
|
Histidina (His) |
|
Alanina (Ala) |
|
|
Isoleucina (Iso) |
|
Arginina (Arg) |
|
|
Leucina (Leu) |
|
Asparagina (Asn) |
|
|
Lisina (Lis) |
|
Ácido aspártico (Asp) |
|
|
Metionina (Met) |
|
Cisteína (Cis) |
|
|
Fenilalanina (Fen) |
|
Ácido glutâmico (Glu) |
|
|
Treonina (Tre) |
|
Glicina (Gli) |
|
|
Triptofano (Tri) |
|
Glutamina (Gln) |
|
|
Valina (Val)
|
|
Prolina (Pro) |
|
|
Serina (Ser) |
|
||
|
Tirosina (Tir) |
|
||
Todos os aminoácidos naturais apresentam o grupo amina em posição 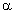 . Com exceção da glicina, são todos opticamente ativos.
. Com exceção da glicina, são todos opticamente ativos.
O que diferencia um aminoácido de outro é o radical R.
Reações dos Aminoácidos
Como já vimos, qualquer aminoácido contém um grupo carboxila (-COOH), que é ácido, e um grupo amina (-NH2), que é básico. Os aminoácidos podem sofrer diferentes reações químicas, tanto no grupo dos ácidos (– COOH), como no grupo das aminas (-NH2).
Exemplos
- com ácido nitroso, há liberação de N2. Tal reação, característica das aminas primárias, é utilizada na avaliação da dosagem de aminoácidos no sangue;
- sob a ação de enzimas, os aminoácidos sofrem descarboxilação: perdem o grupo – COOH, transformando-se em aminas. Isso ocorre em muitas reações de putrefação.
As Proteínas
As proteínas constituem uma parte essencial da dieta de animais. As proteínas são responsáveis pelo crescimento, construções e reconstrução das partes de nosso corpo. Alimentos contendo muita proteína incluem carne, frango, leite, peixe, ovos, nozes, feijão e queijo.
Se o número de aminoácidos, que formam determinada molécula, for superior a 80, convencionalmente, ela será chamada de proteína. Apesar de existirem somente 20 aminoácidos, o número de proteínas possível é praticamente infinito.
As proteínas diferem entre si devido a quantidade de aminoácidos, os tipos de aminoácidos, e a sequência dos aminoácidos na molécula.
Duas proteínas podem ter os mesmos aminoácidos nas mesmas quantidades, porém se a sequência dos aminoácidos for diferente, as proteínas serão diferentes.
As proteínas simples são formadas exclusivamente por aminoácidos. As proteínas compostas são formadas por cadeias de aminoácidos ligadas a outros grupos – lipídeos, glicídios, etc.
Uma das funções das proteínas é a função estrutural, pois fazem parte da arquitetura das células e tecidos dos organismos. Alguns exemplos de proteínas estruturais são:
- colágeno: proteína presente nos ossos, cartilagens e tendões, e também na pele. Aumenta a resistência desses tecidos à tração;
- hemoglobina: proteína presente nas hemácias. Relacionada ao transporte de gases pelas células vermelhas do sangue;
- queratina: recobre a superfície da pele dos vertebrados terrestres. É o mais abundante componente de unhas, garras, corpos, bicos e pelos dos vertebrados.
Estrutura das Proteínas
A sequência dos aminoácidos na cadeia polipeptídica é o que chamamos de estrutura primária da proteína. Se a estrutura primária de uma proteína for mudada, a proteína é mudada. A estrutura primária é importante para a forma espacial da proteína.
O fio proteico (estrutura primária) não fica esticado, mas sim enrolado como um fio de telefone (forma helicoidal), devido à projeção espacial da ligação peptídica. Essa forma é chamada de estrutura secundária.
Em muitas proteínas a própria hélice (estrutura secundária) sofre dobramento sobre si mesma, adquirindo forma globosa chamada de estrutura terciária.
É essa estrutura terciária (espacial = tridimensional) que determina a função biologicamente ativa, fazendo a proteína trabalhar como enzima, anticorpo, etc.
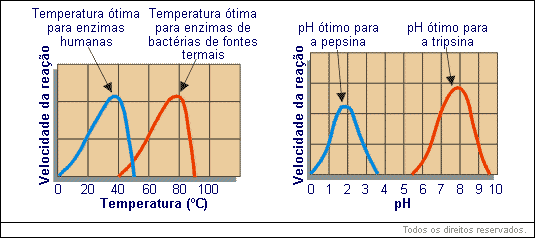
Vários fatores tais como, temperatura, grau de acidez (pH), concentração de sais e outros podem alterar a estrutura espacial de uma proteína, sem alterar a sua estrutura primária. Este fenômeno é chamado de desnaturação.
Enzimas
As proteínas também atuam como catalisadoras das reações químicas que ocorrem nas células. Essas proteínas são chamadas de enzimas. A maior parte das informações contidas no DNA dos organismos, é referente à fabricação de enzimas.
Uma enzima recebe um nome terminado em ase de acordo com a substância sobre a qual atua e o tipo de reação que catalisa.
Cada reação que ocorre na célula necessita de uma enzima específica, isto é, uma mesma enzima não catalisa duas reações diferentes. A especificidade das enzimas é explicada pelo modelo da chave (reagente) e fechadura (enzima). A forma espacial da enzima deve ser complementar à forma espacial dos reagentes (substratos). As enzimas não são descartáveis, uma enzima pode ser usada diversas vezes. A desnaturação de uma enzima implica na sua inatividade, pois perdendo sua forma espacial ela não consegue mais se encaixar ao seu substrato específico.
Muitas enzimas para poderem funcionar precisam de um "ajudante" chamado de cofator. Os cofatores podem ser íons metálicos, como o cobre, zinco e manganês. Se o cofator é uma substância orgânica, ele é denominado coenzima. A maioria das vitaminas necessárias ao nosso organismo atua como coenzima.
Um inibidor enzimático tem forma semelhante ao substrato (reagente). Encaixando-se na enzima, bloqueia a entrada do substrato, inibindo a reação química.
A temperatura e o pH são fatores importantes na velocidade e eficácia da atividade enzimática.
Sumário
- Os Aminoácidos- Reações dos Aminoácidos
- As Proteínas
i. Estrutura das Proteínas
ii. Enzimas
Áreas exclusivas para assinantes