Atomística - Características dos átomos
- Home
- Atomística Características Dos átomos
Características do átomo
O átomo é tão pequeno que não se consegue enxergá-lo, mesmo com a ajuda dos mais poderosos microscópios (dizemos que suas dimensões são submicroscópicas, ou nanoscópicas). É a partir de resultados experimentais, os cientistas formularam um modelo do átomo, denominado modelo atômico. Esse modelo define as características gerais dos átomos.
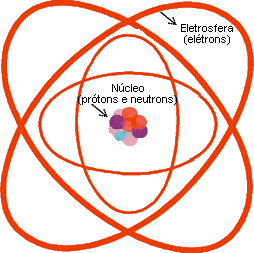
Um átomo é constituído por uma parte central, denominada núcleo, onde se encontram os prótons (partículas elétricas positivas) e os nêutrons (partículas eletricamente neutras).
A região em volta do núcleo é ocupada por elétrons (partículas elétricas negativas); essa região é denominada eletrosfera. A eletrosfera (eletricamente negativa) e o núcleo (eletricamente positivo) mantêm - se unidos por força de atração elétrica.
O diâmetro médio dos átomos é da ordem de 10-10 m e o do núcleo é da ordem de 10-15 m; portanto o diâmetro dos átomos é cerca de 10 mil a 100 mil vezes maior que de seus núcleos. Se o átomo tivesse, por exemplo, a dimensão do Estádio do Maracanã, o núcleo teria a dimensão da bola, no centro do campo. Se o átomo tivesse um diâmetro de 100 m, seu núcleo teria o diâmetro de 1cm.
Nas ilustrações, as dimensões do núcleo são exageradas, pois se fosse representado de forma correta, ele seria tão pequeno que não poderíamos enxergá-lo.
|
Representação gráfica de um átomo. As representações gráficas dos átomos são sempre uma simplificação dos átomos reais. Nelas, as dimensões não são proporcionais às reais. Além disso, nos átomos reais, os elétrons não tem trajetórias fixas e definidas como se fossem órbitas dos planetas em torno do Sol. |
As partículas que compõem os átomos - prótons, nêutrons e elétrons - são denominadas partículas fundamentais. O quadro abaixo mostra os valores da massa e carga elétrica das partículas fundamentais:
|
Partículas fundamentais |
Carga elétrica (Coulomb) |
Massa (grama) |
|
Próton (p) |
+1, 6 x 10-19 C |
1,6 x 10-24 g |
|
Nêutron (n) |
Neutro |
1,6 x 10-24 g |
|
Elétron (e) |
- 1, 6 x 10-19 C |
9,1 x 10-28 g |
A massa do próton é igual à do nêutron. Se considerarmos que a massa de um próton é 1, a massa do nêutron também é 1 e a massa do elétron é 1840 vezes menor que a do próton (e a do nêutron). Podemos dizer que a massa de um átomo está concentrada no seu núcleo.
![]()
|
Partícula |
Carga |
Massa |
|
Próton (p) |
+ |
1 |
|
Nêutron (n) |
Neutro |
1 |
|
Elétron (e) |
- |
1/1840 |
A carga elétrica de um próton é igual à carga elétrica de um elétron, mas de sinal contrário. Assim, considerando a carga elétrica do próton como +1, a carga elétrica do elétron é -1.
Cada elétron anula eletricamente um próton e vice-versa. Por isso, um átomo com mesmo número de prótons e de elétrons é um átomo eletricamente neutro.
Os átomos na linguagem química
Na linguagem química, cada tipo de átomo é denominado elemento químico e é representado por X. Um elemento químico caracteriza-se pelo número de prótons em seu núcleo, chamado de número atômico e representado por Z.
A soma do número de prótons e de nêutrons do núcleo de um átomo é chamado de número de massa, representado por A.
Resumindo:
nº de prótons = p → Z
nº de nêutrons = n
|
A = p + n |
Cada átomo é representado por
![]()
Veja o símbolo de alguns elementos químicos:
H: hidrogênio
O: oxigênio
C: carbono
Au: ouro
Fe: ferro
Cu: cobre
U: urânio
Ti: titânio
|
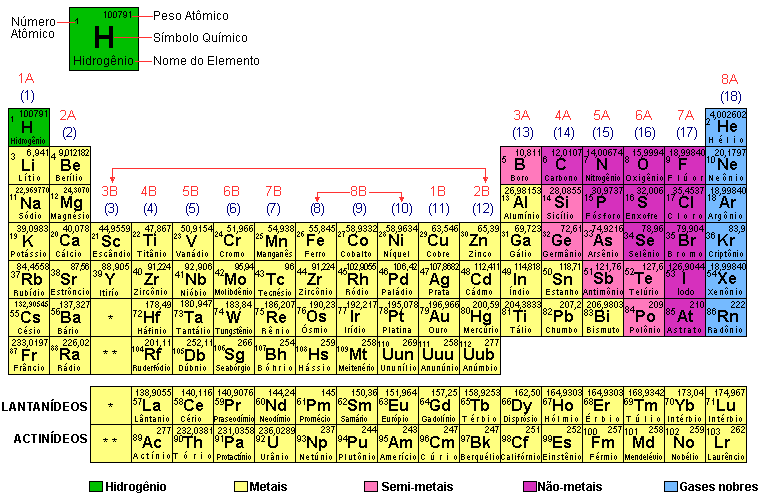
O símbolo (X) e o número atômico (Z) dos elementos químicos conhecidos são encontrados na Tabela Periódica. É uma tabela de consulta utilizada por estudantes e por cientistas; não há necessidade de memorizar as informações que ela contem. |
Número atômico: Z - Elementos químicos
Nós e tudo o que existe em nossa volta é formado de átomos. Mas, se tudo é feito de átomos, por que os materiais de que as coisas são feitas têm cor, consistência, brilho, textura, resistência e tantas outras propriedades diferentes? Como é possível existirem milhares e milhares de materiais, um diferente do outro, se tudo é feito de átomos?
É que os átomos não são todos iguais; existem diferentes tipos de átomos. Na natureza, existem 90 tipos de átomos. Além desses, existem aqueles obtidos nos laboratórios de física; são os átomos de elementos denominados artificiais.
Vimos que cada tipo de átomo é chamado elemento químico. Até o momento são conhecidos 111 elementos químicos: 90 naturais e 21 artificiais.
Vamos ver em que diferem os elementos químicos. Hidrogênio, oxigênio, carbono, ouro, ferro, cobre, urânio, titânio são exemplos de elementos químicos. Todos apresentam átomos com prótons e nêutrons no núcleo e elétrons na eletrosfera, mas são diferentes porque têm diferente número de prótons.
Diferentes elementos químicos têm diferente número atômico, isto é, diferente Z.
O número atômico (Z) identifica os elementos químicos porque revela o número de prótons de seus átomos, isto é, qual é a carga elétrica positiva de seus núcleos (carga nuclear).
|
Elemento químico |
Z |
Significado |
|
1H |
1 |
Átomos de hidrogênio (H) têm 1 próton |
|
8O |
8 |
Átomos de oxigênio (O) têm 8 prótons |
|
6C |
6 |
Átomos de carbono (C) têm 6 prótons |
|
22Ti |
22 |
Átomos de titânio (Ti) têm 22 prótons |
|
26Fe |
26 |
Átomos de ferro (Fe) têm 26 prótons |
|
29Cu |
29 |
Átomos de cobre (Cu) têm 29 prótons |
|
79Au |
79 |
Átomos de ouro (Au) têm 79 prótons |
|
92U |
92 |
Átomos de urânio (U) têm 92 prótons |
|
94Pu |
94 |
Átomos de plutônio (Pu) têm 94 prótons |
|
No caso de um átomo eletricamente neutro, conhecendo o número atômico Z, conhecemos também o número de elétrons de sua eletrosfera:
|
Podemos dizer que o número atômico (Z) define um elemento químico.
Por exemplo:
Z de H é 1, portanto átomos neutros de H tem 1 próton e 1 elétron;
Z de O é 8, portanto átomos neutros de O têm 8 prótons e 8 elétrons.
Para saber qual é o número atômico Z de um elemento químico, consulta-se a Tabela Periódica. Por exemplo, na Tabela Periódica, verifica-se que:
- o elemento químico com Z = 9 é o flúor (F). Portanto, os átomos de flúor têm 9 prótons;
- o elemento químico com Z = 13 é o alumínio (Al) P portanto, átomos de alumínio têm 13 prótons.

Número de massa: A – Isótopos
|
Átomos com mesmo número atômico (Z) e diferente número de massa (A) são chamados isótopos. |
Sabendo qual é o número atômico Z de um elemento químico sabemos qual é sua carga nuclear. Sabendo o número de massa A desse elemento químico, sabemos quantos nêutrons existem em seu núcleo.
Exemplo
14N 56Fe
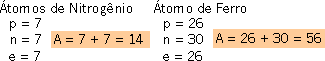
Conhecendo Z e A de um átomo, é possível determinar a quantidade de cada partícula fundamental.

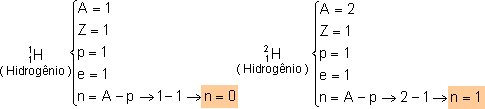
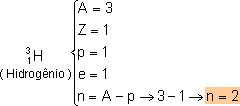
|
Na natureza, os vários isótopos de um elemento formam uma mistura em que existem em uma porcentagem fixa. |
Isótopos do hidrogênio
Todos os átomos de H têm um próton no núcleo, mas nem todos têm o mesmo número de nêutrons. A maior parte dos átomos de H que existem na natureza não tem nenhum nêutron no núcleo; uma pequena parte têm 1 nêutron e outra parte menor ainda têm dois nêutrons. Portanto, o elemento químico H tem 3 isótopos. Eles recebem nomes especiais: hidrogênio (A = 1), ou hidrogênio leve; deutério (A = 2), ou hidrogênio pesado; e trítio (A = 3).
Por exemplo, no caso dos isótopos do H:

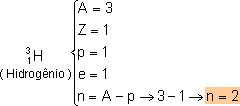
|
Isótopo |
Número de partículas fundamentais no átomo eletricamente neutro |
Porcentagem na natureza |
||
|
p |
n |
e |
||
|
H |
1 |
- |
1 |
99,99 % |
|
D |
1 |
1 |
1 |
0,01 % |
|
T |
1 |
2 |
1 |
traços |
O que significa: porcentagem na natureza de 99,99%?
Significa que, de cada 100 átomos de H que existem na natureza, 99 são de H (A = 1); de cada 10 mil átomos de H que existem na natureza, 1 é de D (A = 2) e que apenas alguns átomos de H presentes na natureza são de T (A = 3).
A molécula de água é formada por dois átomos de hidrogênio e um átomo de oxigênio. Água pesada refere-se às moléculas de água formadas por átomos de deutério (H com A = 2).
H2O - maior parte das moléculas de água
D2O - água pesada
Isótopos do carbono
Todos os átomos de Carbono (C) têm 6 prótons, mas o número de nêutrons varia; a maior parte dos átomos de C que existem na natureza têm 6 nêutrons, uma pequena parte deles têm 7 nêutrons, alguns têm 8. Portanto, o C existe na natureza na forma de 3 isótopos, na seguinte porcentagem:
|
Isótopo |
Número de partículas fundamentais no átomo eletricamente neutro |
Porcentagem na natureza |
||
|
p |
n |
e |
||
|
12C |
6 |
6 |
6 |
98,89% |
|
13C |
6 |
7 |
6 |
1,11% |
|
14C |
6 |
8 |
6 |
traços |
Isótopos do urânio
O urânio (Z = 92) existe na forma de 3 isótopos: urânio 234, 235 e 238.
|
Isótopo |
Número de partículas fundamentais no átomo eletricamente neutro |
Porcentagem na natureza |
||
|
p |
n |
e |
||
|
234U |
92 |
142 |
92 |
0,005% |
|
235U |
92 |
143 |
92 |
0,720% |
|
238U |
92 |
146 |
92 |
99,274% |
Isótopos do césio
O césio (Z = 55), na natureza, existe apenas com número de massa 133. O acidente nuclear que ocorreu em Goiânia, em setembro de 1987, foi causado pelo césio 137, ou seja, isótopo do césio de massa 137, produzido em laboratórios, por meio de reações nucleares.
Isóbaros
Os isóbaros são átomos de elementos químicos diferentes (diferente Z), com mesmo número de massa (A).
Por exemplo:

|
Isóbaros: diferente Z - mesmo A - diferente número de nêutrons |
Isótonos
Isótonos são átomos com mesmo número de nêutrons, mas com números atômico (Z) e de massa (A) diferentes.
Por exemplo:
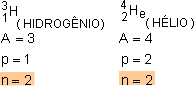
Resumindo:
|
Número atômico, Z |
Número de massa, A |
Número de neutrons |
|
|
ISÓTOPOS |
|
|
|
|
ISÓBAROS |
|
|
|
|
ISÓTONOS |
|
|
|
Representando os elementos hipoteticamente por:
![]()
ISÓBAROS = A e B - mesmo número de massa
ISÓTOPOS = B e D, C e E - mesmo número atômico (mesmo número de prótons)
ISÓTONOS = A, C e D, B e E - mesmo número de nêutrons
Quais átomos devem ser representados pelo mesmo símbolo?
Os isótopos, isto é, aqueles que apresentam o mesmo número atômico (mesmo elemento químico), portanto, B e D, C e E.
Íons
Os átomos se alteram para alcançar a estabilidade. A transformação ocorre na eletrosfera, sem que o núcleo participa dela.
Para alcançar a estabilidade, os átomos perdem ou ganham elétrons, dependendo do caso, e, com isso, adquirem cargas elétricas.
Átomos ou moléculas com carga elétrica – positiva ou negativa – são denominados íons.
|
Íons com carga elétrica positiva são denominados cátions. Íons com carga elétrica negativa são denominados ânions. |
|
Desenhamos o núcleo de forma exagerada, pois se fossemos representá-lo de forma correta, ele seria tão pequeno que não seria possível enxergá-lo. |
Cátions
ÁTOMO ELETRIZADO POSITIVAMENTE (cátion)
Um cátion apresenta mais prótons (cargas positivas) do que elétrons (cargas negativas); portanto, é um átomo que perdeu elétrons. O número de cargas positivas é igual ao número de elétrons perdidos.
Exemplos:
Exemplo de cátion: Ca2+

![]()
![]()
Ânions
ÁTOMO ELETRIZADO NEGATIVAMENTE (ânion)
Um ânion apresenta mais elétrons do que prótons; portanto, adquiriu elétrons. O número de cargas negativas é igual ao número de elétrons adquiridos.
Exemplos:
Exemplo de ânion: N3-
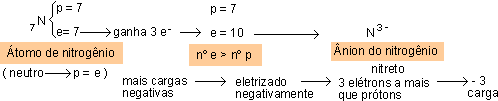
![]()
![]()
Resumindo:

|
Lembrar que em toda alteração na eletrosfera, o número de prótons e de nêutrons permanece inalterado. Por exemplo:
A única diferença entre as espécies químicas Cu, Cu+, Cu2+ está no número de elétrons. |
Valência
Os átomos unem-se por meio de ligações químicas. O número de ligações que um átomo pode formar com outros átomos monovalentes é denominado valência.
Cada ligação química envolve um par de elétrons, um de cada átomo; portanto, o número de cargas elétricas, positivas ou negativas, adquiridas por um átomo, na formação de uma ligação química, indica sua valência.
Exemplo:
|
Al3+ |
|
O2- |
|
Na+ |
|
Lembrando:
CÁTION - CARGA POSITIVA
ÂNION - CARGA NEGATIVA
VALÊNCIA - TOTAL EM CARGAS
|
O símbolo abaixo |
significa: |
|
K+ |
O potássio (K) forma cátion monovalente |
|
Al3+ |
O alumínio (Al) forma cátion trivalente |
|
Cl- |
O cloro (Cl) forma ânion monovalente |
|
O2- |
O oxigênio(O) forma ânion bivalente |
Espécies isoeletrônicas → são átomos ou grupos de átomos que apresentam o mesmo número de elétrons.
Exemplos:

Sumário
- Características do átomo
- Os átomos na linguagem química
- Número atômico: Z - Elementos químicos
- Número de massa: A – Isótopos
- Isótopos do hidrogênio
- Isótopos do carbono
- Isótopos do urânio
- Isótopos do césio
i. Isóbaros
ii. Isótonos
- Íons
i. Cátions
ii. Ânions
- Valência
Áreas exclusivas para assinantes